แนวคิดที่ว่า สิ่งต่าง ๆ ประกอบด้วยอนุภาคที่มีขนาดเล็กมากและมองไม่เห็นด้วยตาเปล่าได้เริ่มขึ้นในสมัยกรีกโบราณ โดยดิโมคริตุส (Democritus) ซึ่งเป็นนักปราชญ์ชาวกรีกผู้หนึ่งที่ได้เสนอแนวคิดว่า ถ้าแบ่งสิ่งต่าง ๆ ให้มีขนาดเล็กลงเรื่อย ๆ จะได้หน่วยย่อยซึ่งไม่สามารถแบ่งให้เล็กลงไปได้อีกและเรียกหน่วยย่อยนี้ว่า อะตอม (atom) ซึ่งมาจากคำในภาษากรีกว่า atomos แปลว่า “แบ่งแยกอีกไม่ได้” นักวิทยาศาสตร์มีวิธีการศึกษาเกี่ยวกับโครงสร้างอะตอมซึ่งมองไม่เห็นด้วยตาเปล่าได้อย่างไรจะได้ศึกษาต่อไป
2.1 แบบจำลองอะตอม
อะตอมมีขนาดเล็กมากและมองไม่เห็นด้วยตาเปล่า แบบจำลองอะตอมมีวิวัฒนาการดังนี้
2.1.1 แบบจำลองอะตอมของดอลตัน
ในปี พ.ศ. 2346 จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎี
อะตอม เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงมวลของสารก่อนและหลังทำปฏิกิริยาเคมี รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่ง ๆ ซึ่งมีสาระสำคัญดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็ก ๆ อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้
สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน เช่น มีมวลเท่ากัน แต่จะมีสมบัติแตกต่าง
จากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็น
เลขลงตัวน้อย ๆ
รูป 2.1 แบบจำลองอะตอมตามทฤษฎีของดอลตัน
ทฤษฎีอะตอมของดอลตันช่วยให้นักวิทยาศาสตร์ในสมัยนั้นสามารถอธิบายลักษณะและ
สมบัติของอะตอมได้เพียงระดับหนึ่ง ต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้น และค้นพบว่ามีข้อมูล
บางประการไม่สอดคล้องกับแนวคิดของดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันมีมวลแตกต่างกันได้ อะตอมสามารถแบ่งแยกได้ แนวคิดเกี่ยวกับทฤษฎีอะตอมของดอลตันจึงไม่ถูกต้อง
2.1.2 แบบจำลองอะตอมของทอมสัน
นักวิทยาศาสตร์หลายคนได้ศึกษาการนำไฟฟ้าของแก๊ส โดยทดลองเกี่ยวกับผลของการใช้ความต่างศักย์ไฟฟ้าสูงต่อการเคลื่อนที่ของประจุไฟฟ้าของอะตอมแก๊ส เพื่อให้ได้ข้อมูลที่ให้รายละเอียดเกี่ยวกับโครงสร้างภายในอะตอม โดยการผ่านไฟฟ้ากระแสตรงเข้าไปในหลอดแก้วบรรจุแก๊สความดันต่ำ (ดูดอากาศออก) ซึ่งที่ภาวะนี้มีจำนวนอะตอมของแก๊สไม่หนาแน่น ประจุไฟฟ้าสามารถเดินทางได้ไกลและพบว่าเมื่อเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้สูงขึ้นจะมีกระแสไฟฟ้าไหลผ่านตลอด ขณะเดียวกันจะมีรังสีออกจากแคโทดไปยังแอโนด รังสีนี้เรียกว่า รังสีแคโทด (cathode ray) เรียกหลอดแก้วชนิดนี้ว่า หลอดรังสีแคโทด (cathode ray tube) เนื่องจากมนุษย์ไม่สามารถมองเห็นรังสีแคโทดด้วยตาเปล่าได้ ดังนั้น เพื่อให้สามารถติดตามทิศทางการเคลื่อนที่ของรังสีแคโทดได้ จึงต้องฉาบสารเรืองแสง เช่น ซิงค์ซัลไฟด์ ฟอสฟอรัส ไว้ที่ฉาก เมื่อรังสีแคโทดตกกระทบที่ฉากจะปรากฏเป็นจุดเรืองแสงที่สามารถสังเกตเห็นด้วยตาเปล่าได้
นักวิทยาศาสตร์ได้ทำการทดลองเพื่อศึกษาการเคลื่อนที่ของรังสีแคโทดโดยให้เคลื่อนที่ผ่านสนามไฟฟ้าดังรูป 2.2 ก) พบว่าแนวการเคลื่อนที่เบนไปจากเดิม โดยเบนเข้าหาขั้วบวกของสนามไฟฟ้าเนื่องจากรังสีแคโทดเบนเข้าหาขั้วบวกของสนามไฟฟ้าจึงสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุไฟฟ้าลบ เมื่อศึกษาเพิ่มเติมโดยให้รังสีแคโทดเคลื่อนที่ผ่านสนามแม่เหล็กดังรูป 2.2 ข) พบว่าแนวการเคลื่อนที่เบนไปจากเดิมเช่นกัน
รูป 2.2
ในช่วงปี พ.ศ. 2440 โจเซฟ จอห์น ทอมสัน (Joseph John Thomson) นักวิทยาศาสตร์ชาวอังกฤษทำการทดลองโดยให้รังสีแคโทดเคลื่อนที่ผ่านสนามไฟฟ้าที่ตั้งฉากกับสนามแม่เหล็ก และปรับขนาดของสนามไฟฟ้าให้พอเหมาะจนกระทั่งทิศทางการเคลื่อนที่ของรังสีแคโทดไม่เบนไปจากแนวเดิม ดังรูป2.2 ค) ซึ่งสภาวะนี้แรงที่เกิดขึ้นจากสนามไฟฟ้าและสนามแม่เหล็กมีขนาดเท่ากันแต่มีทิศตรงข้ามกันจากข้อมูลการทดลองร่วมกับทฤษฎีทางแม่เหล็กไฟฟ้าทำให้ทอมสันนำมาใช้คำนวณอัตราส่วนของประจุต่อมวล (e/m) ของรังสีแคโทดได้ ทอมสันได้ทดลองเพื่อศึกษาอัตราส่วนของประจุต่อมวลของรังสีแคโทดซ้ำหลายครั้งโดยเปลี่ยนชนิดของแก๊สและชนิดของโลหะที่ใช้ทำขั้ว แคโทดปรากฏว่า อัตราส่วนของประจุต่อมวลของรังสีแคโทดมีค่าโดยประมาณเท่ากันคือ 1.76 × 10⁸ คูลอมบ์ต่อกรัม(C/g) จึงสรุปว่าอนุภาครังสีแคโทดที่ออกมาจากโลหะต่างชนิดเป็นอนุภาคชนิดเดียวกัน ซึ่งต่อมาได้เรียกอนุภาคนี้ว่า อิเล็กตรอน (electron)
การค้นพบอิเล็กตรอนทำให้ทอมสันสรุปได้ว่า อะตอมทุกชนิดมีอิเล็กตรอนเป็นองค์ประกอบ ซึ่งลบล้างแนวคิดที่ว่าอะตอมแบ่งแยกไม่ได้ และเนื่องจากสารต่าง ๆ ที่อยู่ในสภาวะปกติจะเป็นกลางทางไฟฟ้า นักวิทยาศาสตร์จึงสรุปว่า อะตอมเป็นกลางทางไฟฟ้า ซึ่งจากข้อมูลดังกล่าวทำให้ทอมสันเสนอแบบจำลองของอะตอมว่า อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไป ดังรูป 2.3 อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
รูป 2.3
ทอมสันเป็นนักวิทยาศาสตร์คนแรกที่เสนอรายละเอียดภายในอะตอม ทำให้มโนภาพของอะตอมชัดเจนขึ้น อย่างไรก็ตามในช่วงเวลาต่อมานักวิทยาศาสตร์ได้ทำการทดลองเพิ่มเติมและมีข้อมูลเพิ่มขึ้น ซึ่งแบบจำลองอะตอมของทอมสันไม่สามารถอธิบายได้
2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
เมื่อปี พ.ศ. 2454 เออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) นักวิทยาศาสตร์ชาวอังกฤษและ ฮันส์ ไกเกอร์ (Hans Geiger) นักวิทยาศาสตร์ชาวเยอรมัน ได้พิสูจน์แบบจำลองอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ
รัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่า การที่รังสีแอลฟาส่วนใหญผ่านแผ่น ทองคำ ไปได้แสดงว่า ภายในอะตอมต้องมีที่ว่างอยู่เป็นบริเวณกว้าง การที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านหน้าของฉากเรืองแสง แสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมาก มีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวก รัทเทอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมใหม่ว่า อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ภายในและมีประจุไฟฟ้าเป็นบวก โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ ดังรูป 2.4
รูป 2.4
ตามแบบจำลองของรัทเทอร์ฟอร์ด ภายในอะตอมมีนิวเคลียสซึ่งมีขนาดเล็กมาก เมื่อเทียบกับขนาดของอะตอม รังสีแอลฟาจึงมีโอกาสชนนิวเคลียสได้น้อยมาก ส่วนอิเล็กตรอนที่อยู่รอบนิวเคลียสมีมวลน้อยมาก การชนกับอิเล็กตรอนจึงไม่มีผลทำให้ทิศทางการเคลื่อนที่ของรังสีแอลฟาเปลี่ยนไปรังสีส่วนใหญ่จึงทะลุแผ่นทองคำไปเป็นแนวตรง มีบางครั้งที่รังสีแอลฟาวิ่งเฉียดนิวเคลียส ซึ่งจะถูกประจุของนิวเคลียสผลักให้เบนไปจากแนวเส้นตรง ส่วนรังสีแอลฟาที่วิ่งตรงไปยังนิวเคลียสซึ่งมีมวลมากก็จะถูกผลักให้สะท้อนกลับ ดังแสดงในรูป 2.5
รูป 2.5 การใช้แบบจำลองอธิบายผลการทดลองของรัทเทอร์ฟอร์ด
ตามแนวคิดของรัทเทอร์ฟอร์ดจะพบว่ามวลส่วนใหญ่ของอะตอมคือมวลของนิวเคลียส ส่วนอิเล็กตรอนถึงแม้จะเป็นส่วนประกอบที่ทำให้อะตอมมีขนาดใหญ่แต่มีมวลน้อยมากจนถือว่าไม่มีผลต่อมวลของอะตอม
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ไม่ได้อธิบายว่าอิเล็กตรอนอยู่รอบนิวเคลียสในลักษณะใดนักวิทยาศาสตร์จึง ได้ทำการทดลองเพื่อ รวบรวมข้อมลูเพิ่มเติมเกี่ยวกับตำแหน่งของอิเล็กตรอนเพื่อ นำมาสร้างเป็นแบบจำลองที่มีความสมบูรณ์มากยิ่งขึ้น
2.1.4. แบบจำลองอะตอมของโบร์
สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่าง ๆ กัน และมีความถี่ต่อเนื่องกันเป็นช่วงกว้าง มีทั้งที่มองเห็นได้และมองไม่เห็น มีชื่อเรียกต่าง ๆ กัน แสงที่ประสาทตาของมนุษย์สามารถรับรู้ได้เรียกว่า แสงที่มองเห็นได้ (visible light) มีความยาวคลื่นอยู่ในช่วง400–700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่าง ๆ กัน แต่ประสาทตาของมนุษย์ไม่สามารถแยกแสงที่มองเห็นเป็นสีต่าง ๆ ได้เอง ทำให้มองเห็นสีรวมกัน ซึ่งเรียกว่า แสงขาว (white light) และเมื่อให้แสงขาวส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกัน เรียกว่า แถบสเปกตรัมของแสงขาว ดังรูป 2.6
รูป 2.6
มักซ์ พลังค์ (Max Planck) นักวิทยาศาสตร์ชาวเยอรมัน ได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสัมพันธ์ระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่า พลังงานของคลื่นแม่เหล็กไฟฟ้าแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวคลื่น ดังความ สัมพันธ์ต่อไปนี้
เมื่อ
E คือพลังงานของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็น จูล
h คือค่าคงตัวของพลังค์ มีค่า 6.626 × 10^-34 จูลวินาที
ν คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้าในสุญญากาศ ซึ่งเท่ากับ 2.997 × 10^8 เมตรต่อวินาที(อาจใช้3.0 × 10^8 เมตรต่อวินาที)
และ λ คือความยาวคลื่นของคลื่นแม่เหล็กไฟฟ้า หน่วยเป็นเมตร
ความสัมพันธ์ดังกล่าวนี้เมื่อนำ มาคำ นวณพลังงานของแถบสีต่าง ๆ ในสเปกตรัมของแสงขาว ซึ่งมีความยาวคลื่นต่าง ๆ จะได้ดังนี้
สเปกตรัมจากแสงอาทิตย์มีแสงสีต่อเนื่องกันเป็น แถบสเปกตรัม (spectrum band) ส่วนสเปกตรัมที่มองเห็นจากหลอดฟลูออเรสเซนต์นอกจากจะมองเห็นแถบสเปกตรัม ของสีต่าง ๆ เป็นพื้นแล้วยังมีเส้นสีต่าง ๆ ปรากฏในแถบสเปกตรัมด้วย และจากการสังเกตสเปกตรัม ของแก๊สไฮโดรเจน ฮีเลียม นีออน และไอปรอท พบว่าธาตุแต่ละชนิดให้สเปกตรัมที่มีเส้นสีต่างกันและมี จำ นวนเส้นสีเฉพาะตัว เส้นสีต่าง ๆ นี้เรียกว่า เส้นสเปกตรัม (spectrum line)
รูป 2.7 แถบสเปกตรัมของแสงขาวและเส้นสเปกตรัมของธาตุบางชนิด
ธาตุต่าง ๆ เมื่อได้รับพลังงานจะเปล่งแสงเป็นสีต่าง ๆ หลายสีเมื่อสีเหล่านั้นรวมกันแล้วจะ สังเกตเห็นเป็นสีเดียวซึ่งตาเราไม่สามารถบอกความแตกต่างได้ แต่เมื่อใช้แผ่นเกรตติงส่องดูจะเห็น เส้นสเปกตรัมของแต่ละธาตุที่มีลักษณะเฉพาะ เช่น จำ นวนเส้น สีหรือตำ แหน่งที่เกิดต่างกันไป การเกิด เส้นสเปกตรัมของธาตุอธิบายได้ว่า อิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบนิวเคลียสมีพลังงานเฉพาะตัว ที่ต่ำ หรือกล่าวได้ว่าอะตอมอยู่ใน สถานะพื้น (ground state) เมื่ออะตอมได้รับพลังงานเพิ่มขึ้นทำ ให้ อิเล็กตรอนถูกกระตุ้นให้มีพลังงานสูงขึ้นหรือเรียกว่าอะตอมอยู่ใน สถานะกระตุ้น (excited state) ที่สถานะนี้อะตอมจะไม่เสถียร เนื่องจากมีพลังงานสูง อิเล็กตรอนจึงคายพลังงานออกมาส่วนหนึ่ง ทำ ให้อะตอมมีพลังงานลดลงแล้วกลับเข้าสู่สถานะที่มีพลังงานต่ำ ลงเพื่อให้อะตอมมีความเสถียร มากขึ้น พลังงานส่วนใหญ่ที่คายออกมาจะปรากฏในรูปพลังงานแสง และสามารถคำ นวณได้โดย ใช้ความสัมพันธ์ตามสมการของพลังค์ซึ่งได้กล่าวไว้แล้วในข้างต้น ถ้าแสงสีเหล่านี้แยกออกจากกัน อย่างชัดเจนจะปรากฏเป็นเส้นสเปกตรัม แต่ถ้าแสงสีที่ปรากฏออกมามีลักษณะต่อเนื่องกันเช่นเดียว กับรุ้งหรือจากไส้หลอดไฟฟ้าซึ่งเป็นโลหะร้อนและมีอะตอมอยู่กันอย่างหนาแน่น จะให้สเปกตรัมเป็น แถบสเปกตรัมซึ่งยากแก่การวิเคราะห์และแปลผล สภาวะของอิเล็กตรอนที่มีพลังงานต่าง ๆ เรียกว่า ระดับพลังงานของอิเล็กตรอน (energy level of electron)
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนซึ่งมี1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัม ปรากฏในช่วงคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 434 486 และ 656 นาโนเมตร ตามลำ ดับ เมื่อคำ นวณผลต่างระหว่างพลังงานของเส้นสเปกตรัมที่อยู่ถัดกัน จะได้ข้อมูลดังตาราง 2.2
จากข้อมูลในตาราง 2.2 แสดงว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับโดยความแตกต่าง ระหว่างพลังงานแต่ละระดับที่อยู่ถัดไปมีค่าไม่เท่ากันและความแตกต่างของพลังงานมีค่าน้อยลงเมื่อ ระดับพลังงานสูงขึ้น
การที่นักวิทยาศาสตร์ใช้อะตอมของไฮโดรเจนเป็นตัวอย่างในการแปลความหมายของเส้นสเปกตรัม เพราะอะตอมของไฮโดรเจนมีอิเล็กตรอนเดียว จากการทดลองหลายครั้งพบว่า อะตอมของไฮโดรเจนให้ เส้นสเปกตรัมได้หลายเส้นที่มีลักษณะเหมือนกันทุกครั้ง จึงสรุปได้ว่าอิเล็กตรอนในอะตอมของไฮโดรเจน ขึ้นไปอยู่ในสถานะกระตุ้นที่มีพลังงานแตกต่างกันได้หลายระดับ ค่าพลังงานของเส้นสเปกตรัมแสดงให้เห็น ถึงการเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมจากระดับพลังงานสูงมายังระดับพลังงานต่ำ ดังรูป 2.8
รูป 2.8 การเปลี่ยนระดับพลังงานของอิเล็กตรอนในอะตอมของไฮโดรเจน
การเปลี่ยนแปลงพลังงานของอิเล็กตรอนระหว่างสถานะกระตุ้นและสถานะพื้นสามารถ อุปมานได้กับการกลิ้งลงขั้นบันไดของลูกบอล ดังรูป 2.9
รูป 2.9
จากรูปจะเห็นว่าพลังงานศักย์ณ บันไดแต่ละขั้นมีค่าไม่เท่ากัน โดยลูกบอลที่อยู่บันไดขั้นต่ำ จะมีพลังงานศักย์ต่ำ กว่าบันไดขั้นสูง และผลต่างของพลังงานระหว่างบันไดสองขั้นมีค่าเฉพาะตัว ที่แน่นอน โดยขั้นบันไดที่อยู่ห่างกันมากจะมีผลต่างของพลังงานมากกว่าขั้นบันไดที่อยู่ติดกัน เช่น ผลต่างของพลังงานระหว่างขั้นที่ 1 กับขั้นที่ 3 จะมีค่ามากกว่าขั้นที่ 1 กับขั้นที่ 2 หรืออาจสรุปได้ว่า ผลต่างของพลังงานศักย์ระหว่างขั้นบันไดขึ้นอยู่กับความแตกต่างระหว่างความสูงของขั้นบันไดและ มีค่าเฉพาะตัว การกลิ้งลงขั้นบันไดของลูกบอล ลูกจะต้องกลิ้งลงและหยุดที่ขั้นบันไดเท่านั้น ลูกบอล ไม่สามารถหยุดระหว่างขั้นบันไดได้เนื่องจากไม่มีที่พักระหว่างขั้นบันได ลูกบอลอาจกลิ้งและหยุดบน ขั้นบันไดขั้นที่ติดกันหรือขั้นที่อยู่ห่างออกไปได้เช่น จากขั้นที่ 5 ลงมายังขั้นที่ 4 หรือจากขั้นที่ 3 ลง มาขั้นที่ 1
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนทำ ให้นักวิทยาศาสตร์สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงานในปริมาณที่เหมาะสม อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงาน ที่สูงกว่าระดับพลังงานเดิม แต่จะอยู่ในระดับใดขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอน ขึ้นไปอยู่ในระดับพลังงานใหม่ทำ ให้อะตอมไม่เสถียร อิเล็กตรอนจะกลับมาอยู่ในระดับพลังงานที่ต่ำ กว่า ซึ่งการเปลี่ยนตำ แหน่งของแต่ละระดับพลังงานนี้ อิเล็กตรอนจะคายพลังงานออกมาในรูปของ คลื่นแม่เหล็กไฟฟ้าด้วยความถี่เฉพาะค่าหนึ่งหรือกล่าวได้ว่าการดูดหรือคายพลังงานของอิเล็กตรอน ในอะตอมต้องมีค่าเฉพาะตามทฤษฎีของพลังค์โดยมีค่าเท่ากับความถี่ของคลื่นแม่เหล็กไฟฟ้านั้นคูณ ด้วยค่าคงที่ของพลังค์ดังที่กล่าวมาแล้ว
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำ เป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกัน อาจมีการเปลี่ยนข้ามระดับพลังงานได้และจะอยู่ระหว่างระดับพลังงานไม่ได้
3. ผลต่างระหว่างพลังงานของระดับพลังงานต่ำ จะมีค่ามากกว่าผลต่างระหว่างพลังงานของ ระดับพลังงานที่สูงขึ้นไป
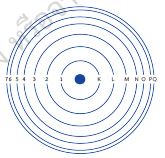
จากความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัม ช่วยให้ นีลส์ โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก สร้างแบบจำ ลองอะตอมเพื่อใช้อธิบาย พฤติกรรมของอิเล็กตรอนในอะตอมได้ โดยกล่าวว่า อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็น วงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดมีพลังงานต่ำ ที่สุดเรียกว่าระดับ K และระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L M N … ตามลำดับ ดังรูป 2.10
รูป 2.10 แบบจำลองอะตอมของโบร์ที่แสดงระดับพลังงานของอิเล็กตรอน
ต่อมาได้มีการใช้ตัวเลขแสดงถึงระดับพลังงานของอิเล็กตรอน คือ n = 1 หมายถึงระดับ พลังงานที่ 1 ซึ่งอยู่ ใกล้กับนิวเคลียสที่สุด และชั้นถัดออกมาเป็น n = 2 หมายถึงระดับพลังงานที่ 2 ต่อจากนั้นn = 3 4 … หมายถึงระดับ พลังงานที่ 3 4 และสูงขึ้นไปตามลำดับ
2.1.5 แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมของโบร์มีข้อจำกัดคือไม่สามารถใช้อธิบายสเปกตรัมของอะตอมที่มีหลาย อิเล็กตรอนได้นักวิทยาศาสตร์จึงได้ศึกษาเพิ่มเติมจนได้ข้อมูลเพียงพอที่จะเชื่อว่าอิเล็กตรอนมีสมบัติ เป็นทั้งอนุภาคและคลื่นโดยเคลื่อนที่รอบนิวเคลียส บริเวณที่พบอิเล็กตรอนมีหลายลักษณะเป็นรูปทรง ต่าง ๆ ตามระดับพลังงานของอิเล็กตรอน จากการประยุกต์ใช้สมการทางคณิตศาสตร์และใช้คอมพิวเตอร์ ช่วยในการคำ นวณ เพื่อหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่าง ๆ พบว่าสามารถอธิบาย เส้นสเปกตรัมของธาตุได้ถูกต้องกว่าแบบจำลองอะตอมของโบร์และสามารถอธิบายได้ว่าอิเล็กตรอน มีขนาดเล็กมากและเคลื่อนที่อย่างรวดเร็วตลอดเวลาไปทั่วทั้งอะตอม จึงไม่สามารถบอกตำแหน่งที่แน่นอน ของอิเล็กตรอนได้ อย่างไรก็ตามนักวิทยาศาสตร์พบว่ามีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียส บางบริเวณเท่านั้น ทำ ให้สร้างมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอน (electron cloud) รอบนิวเคลียส บริเวณที่กลุ่มหมอกทึบแสดงว่ามีโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณ ที่มีกลุ่มหมอกจาง เรียกแบบจำลองนี้ว่าแบบจำลองอะตอมแบบกลุ่มหมอก (electron cloud model of atom) ดังรูป 2.11 (แต่ละจุดคือ 1 โอกาสที่จะพบอิเล็กตรอน)
แบบจำลองอะตอมแบบกลุ่มหมอกที่แสดงถึงความหนาแน่นของอิเล็กตรอนรอบนิวเคลียส ทำได้ยาก โดยทั่วไปจึงพิจารณาอะตอมในลักษณะทรงกลม เช่น ลูกปิงปอง หรือพลาสติกทรงกลม เป็นแบบจำลองแทนอะตอมของธาตุ แต่นักเรียนควรระลึกไว้เสมอว่าการใช้แบบจำ ลองเช่นนี้เพียง เพื่อช่วยให้คิดตามได้ง่ายขึ้นเท่านั้น เมื่อนักเรียนได้ศึกษาในระดับที่สูงขึ้นไปจะพบว่ารูปทรงของกลุ่ม หมอกอิเล็กตรอนไม่ได้มีเพียงรูปทรงกลมเท่านั้น
โครงสร้างอะตอมตามแบบจำลองอะตอมแบบกลุ่มหมอกยังไม่ใช่ข้อยุติในการศึกษาทดลองเกี่ยวกับอะตอม เพราะความรู้ทางวิทยาศาสตร์มีการพัฒนาอย่างต่อเนื่องตลอดเวลา ดังนั้นในอนาคตจึงอาจมีแบบจำลองอะตอมแบบอื่นตามข้อมูลที่ค้นพบใหม่
2.2 อนุภาคในอะตอมและไอโซโทป
ในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวล ในหัวข้อนี้นักเรียนจะได้เรียนรู้เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ. 2451 รอเบิร์ต แอนดรูส์มิลลิแกน (Robert Andrews Millikan) นักวิทยาศาสตร์ ชาวอเมริกันได้ทำ การหาค่าประจุของอิเล็กตรอนโดยอาศัยการสังเกตหยดน้ำ มันในสนามไฟฟ้า ดังรูป 2.12
รูป 2.12 การทดลองหยดน้ำมันมิลลิแกน
เมื่อละอองน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้น ทำให้ละออง น้ำมันบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวก บางหยดเข้าหาขั้วไฟฟ้าลบ และบางหยดลอยนิ่งอยู่ระหว่าง สนามไฟฟ้า ขนาดของหยดน้ำมันที่ลอยนิ่งอยู่ระหว่างสนามไฟฟ้าสามารถสังเกตได้จากกล้องจุลทรรศน์ และนำมาคำนวณหามวลของหยดน้ำมันที่ทราบความหนาแน่นของน้ำมัน และจากความสัมพันธ์ของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้า ทำให้สามารถคำ นวณค่าประจุไฟฟ้าบนหยดน้ำมันได้ซึ่งพบว่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่าของ 1.60 × 10^-19 คูลอมบ์ มิลลิแกนจึงสรุปว่าประจุของอิเล็กตรอนมีค่าเท่ากับ 1.60 × 10^-19 คูลอมบ์เมื่อนำ มาใช้คำนวณร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้มวลของอิเล็กตรอนเท่ากับ 9.11 × 10^-28 กรัม
ในปีพ.ศ. 2429 ออยเกน โกลด์ชไตน์(Eugen Goldstein) ได้ทำ การดัดแปลงหลอดรังสีแคโทด โดยการสลับตำแหน่งของแคโทดและแอโนด ดังรูป 2.13 ซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่า ฉาก เกิดการเรืองแสง แสดงว่ามีรังสีออกจากแอโนด ซึ่งโกลด์ชไตน์เรียกรังสีชนิดนี้ว่า รังสีแคแนล (canal ray) หรือรังสีแอโนด (anode ray) ซึ่งมีประจุบวก
รูป 2.13 หลอดรังสีแคโทดที่ดัดแปลง
โกลด์ชไตน์ได้ทำ การทดลองกับแก๊สหลายชนิดพบว่ารังสีแอโนดมีค่าประจุต่อมวล (e/m) ไม่คงที่ จนกระทั่งกลุ่มนักวิจัยนำ ทีมโดยรัทเทอร์ฟอร์ดและทอมสัน ได้ทำ การศึกษาหลอดในลักษณะเดียวกัน ที่บรรจุแก๊สไฮโดรเจน ทำ ให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากันกับอิเล็กตรอน และหาค่ามวล ของประจุบวกได้เป็น 1.673 × 10^-24 กรัม ซึ่งมากกว่ามวลของอิเล็กตรอนประมาณ 1,840 เท่า เรียก อนุภาคนี้ว่า โปรตอน (proton)
ในปีพ.ศ. 2475 เจมส์แชดวิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิง อนุภาคแอลฟาไปยังอะตอมของธาตุต่าง ๆ และทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงสูง ทำ ให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกอนุภาคนี้ว่า นิวตรอน (neutron) ซึ่งมีมวลใกล้เคียงกับมวลของโปรตอน การค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับ มวลของอะตอม ซึ่งพบว่ามีค่ามากกว่ามวลรวมของโปรตอน เช่น ธาตุคาร์บอนมีมวลของโปรตอน รวมกัน 6 หน่วย แต่มวลของอะตอมมีค่า 12 หน่วย และมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือ มากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกัน ดังนั้น อิเล็กตรอน โปรตอน และนิวตรอน จึงเป็น อนุภาคในอะตอม (subatomic particle) ซึ่งอนุภาคแต่ละชนิดมีรายละเอียดดังตาราง 2.3
2.2.2 เลขอะตอม เลขมวล และไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอม และมีอิเล็กตรอน ซึ่งมีจำ นวนเท่ากับจำ นวนโปรตอนเคลื่อนที่อยู่รอบนิวเคลียส อะตอมของธาตุแต่ละชนิดมีจำ นวน โปรตอนเฉพาะตัวไม่ซ้ำ กับธาตุอื่น ตัวเลขที่แสดงจำ นวนโปรตอนเรียกว่า เลขอะตอม (atomic number, Z) และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมาก ดังนั้นมวลของอะตอมส่วนใหญ่จึงเป็น มวลของนิวเคลียสที่ประกอบด้วยโปรตอนและนิวตรอน เรียกผลรวมของจำ นวนโปรตอนและ นิวตรอนว่า เลขมวล (mass Number, A) เช่น คาร์บอนมี6 โปรตอนจึงมีเลขอะตอมเท่ากับ 6 โดย อาจมี 6 หรือ 7 นิวตรอน จึงมีเลขมวลเป็น 12 หรือ 13 ตามลำดับ
สัญลักษณ์ที่เขียนแสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุเลขอะตอม และเลขมวลของ อะตอม เรียกว่า สัญลักษณ์นิวเคลียร์ (nuclear symbol) วิธีเขียนที่ตกลงกันเป็นสากล ให้เขียน เลขอะตอมไว้ด้านล่างซ้าย และเลขมวลไว้ด้านบนซ้ายของสัญลักษณ์ดังรูป 2.14
รูป 2.14 สัญลักษณ์นิวเคลียร์
อะตอมของธาตุชนิดเดียวกันมีจำ นวนโปรตอนและอิเล็กตรอนเท่ากัน แต่จำ นวนนิวตรอน อาจมีได้หลายค่า ทำ ให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี(Frederick Soddy) นักเคมีชาวอังกฤษ เรียกอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่า ไอโซโทป (isotope) ธาตุชนิด หนึ่งอาจมีหลายไอโซโทป บางไอโซโทปมีอยู่ในธรรมชาติและบางไอโซโทปได้จากการสังเคราะห์เช่น ไฮโดรเจน มี3 ไอโซโทป มีเลขมวล 1 2 และ 3 มีชื่อเฉพาะว่า โปรเทียม (protium) ดิวทีเรียม (deuterium) และ ทริเทียม (tritium) ตามลำ ดับ ไฮโดรเจนที่เกิดในธรรมชาติมีปริมาณโปรเทียมอยู่ถึง ร้อยละ 99.99 แต่ละไอโซโทปของไฮโดรเจนเขียนสัญลักษณ์นิวเคลียร์ได้เป็น ₁¹H ₁²H และ ₁³H อาจเขียนอย่างย่อโดยเขียนเฉพาะสัญลักษณ์ของธาตุกับเลขมวลก็ได้โดยเขียนเป็น ¹H ²H และ ³H หรือ H-1 H-2 และ H-3 แต่ละไอโซโทปของไฮโดรเจนมีชื่อเฉพาะ และใช้สัญลักษณ์แทนดังตาราง 2.4
คาร์บอนมีเลขอะตอม 6 มี3 ไอโซโทป ซึ่งมีเลขมวล 12 13 และ 14 สัญลักษณ์นิวเคลียร์ จึงเป็น¹²₆C ¹³₆C และ ¹⁴₆C เขียนแบบย่อเป็น ¹²C ¹³C และ ¹⁴C หรือ C-12 C-13 และ C-14 การเรียก ชื่อของไอโซโทปของธาตุจะเรียกขึ้นต้นด้วยชื่อของธาตุและตามด้วยเลขมวล เช่น ¹⁴C มีเลขมวล 14จะมี6โปรตอน และ 8 นิวตรอน เรียกไอโซโทปนี้ว่า คาร์บอน-14 (C-14)
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาแบบจำลองอะตอม ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอน อยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ และอยู่ในระดับพลังงานต่างกัน อิเล็กตรอน เหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีจำ นวนอิเล็กตรอนสูงสุดเท่าใด ให้นักเรียน พิจารณาข้อมูลแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุดังตาราง 2.5
เมื่อพิจารณาข้อมูลในตาราง 2.5 จะพบว่าจำ นวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มาก ที่สุด 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 8 อิเล็กตรอน สำ หรับระดับพลังงานที่ 3 นั้น จากการสืบค้นข้อมูลเพิ่มเติมทำ ให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน นั่นคือ จำ นวนอิเล็กตรอน มากที่สุดที่มีได้ในแต่ละระดับพลังงานจะมีค่าเท่ากับ 2n² เมื่อ n คือ ตัวเลขแสดงระดับพลังงาน ถ้าพิจารณาตามหลัก 2n² การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 2 8 9 และ 2 8 10 ตามลำ ดับ เนื่องจากในระดับพลังงานที่ 3 ควรมีอิเล็กตรอนได้สูงสุดถึง 18 อิเล็กตรอน แต่ จากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตาม ลำ ดับ ซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของทั้งสองธาตุนี้มีเพียง 8 อิเล็กตรอน และ อิเล็กตรอนที่เพิ่มมาอีก 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำ ให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 ข้อมูลดังกล่าวนี้จะได้ศึกษาต่อไป
2.3.2 ระดับพลังงานหลัก และระดับพลังงานย่อย
นักเรียนทราบมาแล้วว่าโบร์เสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของ ไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่าง พลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน โดยความแตกต่างของพลังงานจะมีค่าน้อยลง เมื่อมี ระดับพลังงานสูงขึ้น การอธิบายเกี่ยวกับเส้นสเปกตรัมของโบร์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความ สนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสง ออกมาและมองเห็นเป็น 1 เส้นนั้นแท้จริงแล้วประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้น ซึ่งนำ ไปสู่ข้อสรุปที่ว่า เส้นสเปกตรัมที่เกิดขึ้น นอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลัก (principle energy level หรือ shell) ซึ่งแทนด้วย n แล้ว ยังเป็นการคายพลังงานของอิเล็กตรอนจาก ระดับพลังงานย่อย (energy sublevel หรือ subshell) ของแต่ละระดับพลังงานหลักอีกด้วย
นักวิทยาศาสตร์ได้กำ หนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำ ดับ แนวคิด ดังกล่าวนี้สามารถนำ มาอธิบายสเปกตรัมของธาตุที่มีมากกว่า 1 อิเล็กตรอนได้ และจากการศึกษา เพิ่มเติมพบว่าจำ นวนระดับพลังงานย่อยที่เป็นไปได้ในแต่ละระดับพลังงานหลักที่ 1 – 4 เป็นดังนี้
รูป 2.15 แผนภาพระดับพลังงานของอะตอมที่มีหลายอิเล็กตรอน
จากรูป 2.15 สามารถสรุปได้ว่า ระดับพลังงานหลักที่ 1 (n = 1) มี1 ระดับพลังงานย่อยคือ s
ระดับพลังงานหลักที่ 2 (n = 2) มี2 ระดับพลังงานย่อยคือ s p
ระดับพลังงานหลักที่ 3 (n = 3) มี3 ระดับพลังงานย่อยคือ s p d
ระดับพลังงานหลักที่ 4 (n = 4) มี4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
เนื่องจากอิเล็กตรอนมีการเคลื่อนที่ตลอดเวลา ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนจึงอยู่ ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกัน บริเวณรอบนิวเคลียส ซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออร์บิทัล (orbital) จากศึกษาพบว่าจำ นวน ออร์บิทัลในแต่ละระดับพลังงานย่อยมีค่าแตกต่างกันซึ่งสามารถสรุปได้ดังนี้
ระดับพลังงานย่อย s มี 1 ออร์บิทัล
ระดับพลังงานย่อย p มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มี 7 ออร์บิทัล
จากรูป 2.15 ถ้าเขียนเป็นแผนผังโดยพิจารณาออร์บิทัลของแต่ละระดับพลังงานย่อยอาจเขียน แสดงได้ดังรูป 2.16
รูป 2.16
จำนวนอิเล็กตรอนสูงสุดในออร์บิทัลที่อยู่ในระดับพลังงานย่อย s p d และ f สามารถพิจารณาจากข้อมูลในตาราง 2.6
จากตาราง 2.6 จะเห็นว่าจำ นวนอิเล็กตรอนสูงสุดในระดับพลังงานย่อย s p d และ f มีค่าเท่ากับ 2 6 10 และ 14 ตามลำ ดับ แต่เนื่องจากพลังงานย่อย s p d และ f มี1 3 5 และ 7 ออร์บิทัลตามลำ ดับ แสดงว่า 1 ออร์บิทัลสามารถบรรจุอิเล็กตรอนได้2 อิเล็กตรอน
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอนของอะตอมหนึ่ง ๆ ให้พิจารณาตาม หลักอาฟบาว (Aufbau principle) ซึ่งเกี่ยวข้องกับลำ ดับพลังงานของแต่ละออร์บิทัล กล่าวคือการบรรจุอิเล็กตรอนต้องบรรจุในออร์บิทัล ที่มีพลังงานต่ำ สุดและว่างอยู่ก่อนเสมอ ดังรูป 2.17 นั่นคือเริ่มจาก 1s 2s 2p 3s ... ตามลำ ดับ เพราะจะทำ ให้พลังงานรวมทั้งหมดมีค่าต่ำ ที่สุดและอะตอมมีความเสถียรที่สุด
รูป 2.17 แผนภาพแสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ
จากแผนภาพสามารถเรียงลำ ดับพลังงานได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p …
ไฮโดรเจนอะตอมซึ่งมี1 อิเล็กตรอน สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนได้ เป็น 1s¹ โดยมีความหมายดังนี้
รูป 2.18 สัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนของไฮโดรเจนอะตอม
สำหรับธาตุHe Li Be B C N O F Ne Na และ Mg ซึ่งมีอิเล็กตรอน 2 3 4 5 6 7 8 9 10 11 และ 12 ตามลำ ดับ สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนแบบเต็ม และแบบย่อโดยเขียนแก๊สมีสกุลในวงเล็บแทนการจัดเรียงอิเล็กตรอนของแก๊สมีสกุลในชั้นถัดเข้ามา และแสดงการจัดเรียงอิเล็กตรอนเฉพาะชั้นนอกสุด ดังตาราง 2.7
อิเล็กตรอนที่อยู่ในระดับพลังงานหลักสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน (valence electron) เช่น ธาตุเบริลเลียมมีการจัดเรียงอิเล็กตรอนเป็น 1s²2s² จึงมีจำ นวนเวเลนซ์ อิเล็กตรอนเท่ากับ 2 ส่วนฟลูออรีนมีการจัดเรียงอิเล็กตรอนเป็น 1s²2s²2p⁵ จึงมีจำ นวนเวเลนซ์ อิเล็กตรอนเท่ากับ 7
การบรรจุอิเล็กตรอนตามลำ ดับระดับพลังงานโดยอาศัยแผนภาพตามหลักอาฟบาวดังที่ กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่เป็นไปตามหลักการนั้น เช่น
ธาตุ Cr เลขอะตอม 24 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ ได้ดังนี้
1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵ ไม่ใช่ 4s² 3d⁴
ธาตุCu มีเลขอะตอม 29 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ ได้ดังนี้
1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰ ไม่ใช่ 4s² 3d⁹
ธาตุที่ได้รับหรือเสียอิเล็กตรอนสามารถเขียนการจัดเรียงอิเล็กตรอนได้ดังนี้
1. กรณีที่ธาตุได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลักอาฟบาว เช่น
N : 1s² 2s² 2p³
N^3- : 1s² 2s² 2p⁶ (รับเพิ่ม 3 อิเล็กตรอน)
Cl : 1s² 2s² 2p⁶ 3s² 3p⁵
Cl^- : 1s² 2s² 2p⁶ 3s² 3p⁶ (รับเพิ่ม 1 อิเล็กตรอน)
2. กรณีที่ธาตุเสียอิเล็กตรอน ให้บรรจุอิเล็กตรอนตามปกติก่อน จากนั้นจึงนำ อิเล็กตรอนที่ อยู่ชั้นนอกสุดออก เช่น
Al : 1s² 2s² 2p⁶ 3s² 3p¹
Al^3+ : 1s² 2s² 2p⁶ (เสีย 3 อิเล็กตรอน)
Fe : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
Fe^2+ : 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ ไม่ใช่ 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁴ (เสีย 2 อิเล็กตรอน)
2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
ปัจจุบันนักวิทยาศาสตร์ได้ค้นพบธาตุแล้วเป็นจำ นวนมาก ธาตุเหล่านั้นอาจมีสมบัติบางประการ คล้ายกันและบางประการแตกต่างกัน จึงยากที่จะจดจำ สมบัติต่าง ๆ ของแต่ละธาตุได้ทั้งหมด นักวิทยาศาสตร์จึงหาเกณฑ์ในการจัดธาตุที่มีสมบัติคล้ายกันให้อยู่ในกลุ่มเดียวกันเพื่อง่ายต่อการศึกษา นักเรียนคิดว่าสมบัติใดของธาตุที่สามารถใช้เป็นเกณฑ์ในการจัดกลุ่มธาตุ
2.4.1 วิวัฒนาการของการสร้างตารางธาตุ
เมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุต่าง ๆ เหล่านี้แล้ว นักวิทยาศาสตร์ได้หาความสัมพันธ์ ระหว่างสมบัติต่าง ๆ ของธาตุและนำ มาใช้จัดธาตุเป็นกลุ่มได้หลายแบบ ในปีพ.ศ. 2360 โยฮันน์ โวล์ฟกัง เดอเบอไรเนอร์ (Johann Wolfgang Dobereiner) เป็นนักเคมีคนแรกที่พยายามจัดธาตุ เป็นกลุ่ม ๆ ละ 3 ธาตุตามสมบัติที่คล้ายคลึงกันเรียกว่า ชุดสาม (triads) โดยพบว่าธาตุกลางจะมี มวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ เช่น Na มีมวลอะตอม 23.0 และ เป็นธาตุกลางระหว่าง Li กับ K ซึ่งมีมวลอะตอม 6.9 และ 39.1 ตามลำ ดับ ตัวอย่างการจัดธาตุแบบ ชุดสามแสดงได้ดังตาราง 2.8 แต่เมื่อนำ หลักของชุดสามไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน พบว่า ค่ามวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของสองธาตุที่เหลือ หลักชุดสามของ เดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับในเวลาต่อมา
ในปีพ.ศ. 2407 จอห์น นิวแลนด์(John Newlands) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอกฎ ในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมาก พบว่าธาตุที่ 8 จะมีสมบัติ เหมือนกับธาตุที่ 1 เสมอ (ไม่รวมธาตุไฮโดรเจนและแก๊สมีสกุล) เช่น เริ่มต้นเรียงโดยใช้ธาตุ Li เป็น ธาตุที่ 1 ธาตุที่ 8 จะเป็น Na ซึ่งมีสมบัติคล้ายธาตุLi ดังตัวอย่างการจัดต่อไปนี้
การจัดเรียงธาตุตามแนวคิดของนิวแลนด์ใช้ได้ถึงธาตุแคลเซียมเท่านั้น กฎนี้ไม่สามารถอธิบาย ได้ว่าเพราะเหตุใดมวลอะตอมจึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุ ทำ ให้ไม่เป็นที่ยอมรับในเวลา ต่อมา
ในปีพ.ศ. 2412 ยูลิอุส โลทาร์ไมเออร์(Julius Lothar Meyer) นักวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendeleev) นักวิทยาศาสตร์ชาวรัสเซีย ได้ศึกษารายละเอียด ของธาตุต่าง ๆ มากขึ้นทำ ให้มีข้อสังเกตว่า ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปมาก จะพบว่า ธาตุมีสมบัติคล้ายกันเป็นช่วง ๆ การที่ธาตุต่าง ๆ มีสมบัติคล้ายกันเป็นช่วงเช่นนี้เมนเดเลเอฟตั้ง เป็นกฎเรียกว่า กฎพิริออดิก (periodic law) การจัดธาตุเป็นหมวดหมู่ของเมนเดเลเอฟไม่ได้ยึดการ เรียงลำ ดับตามมวลอะตอมจากน้อยไปมากเพียงอย่างเดียว แต่ได้นำ สมบัติที่คล้ายคลึงกันของธาตุที่ ปรากฏซ้ำ กันเป็นช่วง ๆ มาพิจารณาด้วย นอกจากนี้ยังได้เว้นช่องว่างไว้โดยคิดว่าน่าจะเป็นตำ แหน่ง ของธาตุที่ยังไม่ได้มีการค้นพบ โดยที่ตำ แหน่งของธาตุในตารางธาตุมีความสัมพันธ์กับสมบัติของธาตุ เมนเดเลเอฟจึงได้ทำ นายสมบัติของธาตุที่ยังไม่มีการค้นพบ 3 ธาตุ ให้ชื่อว่า เอคา-โบรอน เอคาอะลูมิเนียม และเอคา-ซิลิคอน ในเวลาต่อมาก็ได้ค้นพบธาตุสแกนเดียม แกลเลียม และเจอร์เมเนียม ตามลำ ดับ ซึ่งมีสมบัติใกล้เคียงกับที่ได้ทำ นายไว้ ตัวอย่างธาตุเอคา-ซิลิคอน ซึ่งมีสมบัติใกล้เคียงกับ ธาตุเจอร์เมเนียม เป็นดังนี้
อย่างไรก็ตามเมนเดเลเอฟไม่สามารถอธิบายได้ว่า เพราะเหตุใดจึงต้องจัดเรียงธาตุตามมวลอะตอม เนื่องจากสมัยนั้นนักวิทยาศาสตร์ยังศึกษาโครงสร้างของอะตอมและไอโซโทปได้ไม่ชัดเจน นักวิทยาศาสตร์ รุ่นต่อมาเกิดแนวความคิดว่า ตำ แหน่งของธาตุในตารางธาตุไม่น่าจะขึ้นอยู่กับมวลอะตอมของธาตุ แต่น่าจะขึ้นอยู่กับสมบัติอื่นที่มีความสัมพันธ์กับมวลอะตอม ในปีพ.ศ. 2456 เฮนรีโมสลีย์(Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้เสนอให้จัดธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่าง ๆ ของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุใน ปัจจุบันจึงปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามเลขอะตอมจากน้อยไปมาก
ในหนังสือเรียนนี้จะแสดงเลขหมู่ของตารางธาตุ 2 ระบบที่ต่างกัน ได้แก่ ระบบที่กำ หนดหมู่ ธาตุด้วยเลขโรมันและกำ กับด้วยตัวอักษร A และ B กับระบบที่กำ หนดโดยสหภาพเคมีบริสุทธิ์และ เคมีประยุกต์ระหว่างประเทศ (International Union of Pure and Applied Chemistry , IUPAC) ซึ่งกำ หนดหมู่ของธาตุด้วยตัวเลขอารบิกทั้งหมด ตั้งแต่หมู่ที่ 1 ถึง 18 ดังรูป 2.19
รูป 2.19 ตารางธาตุในปัจจุบัน
ตารางธาตุดังรูป 2.19 แบ่งธาตุในแนวตั้งเป็น 18 แถว โดยเรียกแถวในแนวตั้งว่า หมู่ (group) และแบ่งธาตุในแนวนอนเป็น 7 แถว เรียกแถวในแนวนอนว่า คาบ (period) ซึ่งแต่ละคาบจัดเรียง ธาตุตามเลขอะตอมที่เพิ่มขึ้นตามลำ ดับ จำ นวนธาตุในแต่ละคาบเป็นดังนี้คาบที่ 1 มี 2 ธาตุ
คาบที่ 2 และ 3 มีคาบละ 8 ธาตุ คาบที่ 4 และ 5 มีคาบละ 18 ธาตุ คาบที่ 6 แบ่งเป็น 2 กลุ่ม กลุ่มแรกมี17 ธาตุ คือ Cs ถึง Rn กลุ่มที่สองมี15 ธาตุ คือ La ถึง Lu คาบที่ 7 แบ่งเป็น 2 กลุ่ม เช่นเดียวกัน โดยกลุ่มแรกมี17 ธาตุคือ Fr ถึง Og กลุ่มที่สองมี15 ธาตุคือ Ac ถึง Lr
2.4.2 กลุ่มของธาตุในตารางธาตุ
การที่นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของ ธาตุต่าง ๆ ถ้าแบ่งกลุ่มธาตุตามสมบัติความเป็นโลหะจะแบ่งได้เป็น 3 กลุ่ม คือ ธาตุโลหะ (metal) เป็น ธาตุที่นำ ไฟฟ้าและนำ ความร้อนได้ดี ธาตุกึ่งโลหะ (metalloid) เป็นธาตุที่นำ ไฟฟ้าได้ไม่ดีที่อุณหภูมิ ห้องแต่จะนำ ได้ดีขึ้นเมื่ออุณหภูมิสูงขึ้น และ ธาตุอโลหะ (nonmetal) ซึ่งไม่นำ ไฟฟ้า ยกเว้น คาร์บอน (แกรไฟต์) และ ฟอสฟอรัสดำ เมื่อพิจารณาตำ แหน่งของธาตุในตารางธาตุตามรูป 2.19 พบว่า ธาตุ โลหะอยู่ทางด้านซ้ายมือของตารางธาตุ (สีเขียว) ธาตุกึ่งโลหะจะอยู่บริเวณที่เป็นขั้นบันได (สีชมพู) และธาตุอโลหะจะอยู่ขวามือของตารางธาตุ(สีฟ้า) ยกเว้นไฮโดรเจนอยู่ทางด้านซ้ายมือของตารางธาตุ
ถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอนในออร์บิทัล s p d และ f ที่มีพลังงานสูงสุดและมีอิเล็กตรอนบรรจุอยู่ จะแบ่งธาตุได้เป็น 4 กลุ่มใหญ่คือ ธาตุกลุ่ม s ได้แก่ธาตุ ในหมู่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ ธาตุในหมู่ 13 ถึง 18 (ยกเว้น He) ธาตุกลุ่ม d ได้แก่ ธาตุในหมู่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่ กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่แยกมาจากหมู่ 3 คาบที่ 6 และ 7 ดังรูป 2.20
รูป 2.20 ตำ แหน่งของธาตุตามระดับพลังงานย่อย
ธาตุกลุ่ม s และกลุ่ม p เรียกรวมกันว่า ธาตุกลุ่ม A ซึ่งเป็นกลุ่มของธาตุเรพรีเซนเททีฟ (representative element) หรืออาจเรียกว่ากลุ่มธาตุหมู่หลัก (main group element) เมื่อ พิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่ม A พบว่าธาตุในแนวตั้งที่อยู่ในกลุ่ม A จะมีเวเลนซ์ อิเล็กตรอนเท่ากันและจำ นวนเวเลนซ์อิเล็กตรอนจะตรงกับเลขหมู่ สำ หรับธาตุตามแนวนอนที่อยู่ใน คาบเดียวกัน พบว่ามีจำ นวนระดับพลังงานเท่ากัน และจำ นวนระดับพลังงานจะตรงกับเลขที่คาบ เช่น ธาตุNa มีเลขอะตอมเท่ากับ 11 จัดอิเล็กตรอนเป็น 1s² 2s² 2p⁶ 3s¹ ซึ่งมีจำ นวนอิเล็กตรอนใน แต่ละระดับพลังงานเป็น 2 8 1 ดังนั้น Na จึงอยู่ในหมู่ IA เพราะมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 และอยู่ ในคาบที่ 3 เพราะมีจำ นวนระดับพลังงานของอิเล็กตรอนเท่ากับ 3
ธาตุ Br มีเลขอะตอม 35 จัดอิเล็กตรอนเป็น 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁵ จึงมีจำ นวน อิเล็กตรอนในแต่ละระดับพลังงานเป็น 2 8 18 7 ดังนั้น Br จึงอยู่ในหมู่ VIIA เพราะมีเวเลนซ์ อิเล็กตรอนเท่ากับ 7 และอยู่ในคาบที่ 4 เพราะมีจำ นวนระดับพลังงานของอิเล็กตรอนเท่ากับ 4
ธาตุบางหมู่มีการกำ หนดชื่อที่เป็นสากล เช่น หมู่ IA (1) มีชื่อเรียกว่า โลหะแอลคาไล (alkali metal) ธาตุหมู่ IIA (2) เรียกว่า โลหะแอลคาไลน์เอิร์ท (alkaline earth metal) ธาตุหมู่ VIIA (17) เรียกว่า ธาตุแฮโลเจน (halogen) และหมู่ VIIIA (18) (ยกเว้น Og) เรียกว่า แก๊สมีสกุล (noble gas)
ธาตุกลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือ กลุ่มธาตุแทรนซิชัน (transition element) ซึ่งแบ่งเป็น ธาตุแทรนซิชันชั้นนอก (outer transition) ได้แก่ธาตุกลุ่ม d และ ธาตุแทรนซิชันชั้นใน (inner transition) ได้แก่ธาตุกลุ่ม f โดยธาตุกลุ่ม f ยังสามารถแบ่งได้เป็น 2 กลุ่มย่อย กลุ่มแรกอยู่ คาบที่ 6 และมีเลขอะตอมตั้งแต่ 57–71 (La–Lu) เรียกกลุ่มนี้ว่ากลุ่มธาตุแลนทานอยด์(lanthanoid) กลุ่มที่สองอยู่คาบที่ 7 และมีเลขอะตอมตั้งแต่ 89–103 (Ac–Lr) เรียกกลุ่มนี้ว่ากลุ่มธาตุแอกทินอยด์ (actinoid) เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุแทรนซิชัน พบว่าจำ นวนเวเลนซ์อิเล็กตรอน ส่วนใหญ่เท่ากับ 2 เมื่อพิจารณาธาตุกลุ่มนี้ตามแนวนอนพบว่าจำ นวนระดับพลังงานจะตรงกับเลขที่ คาบเช่นเดียวกับธาตุในกลุ่มธาตุหมู่หลัก
จากการศึกษาการจัดเรียงธาตุในตารางธาตุ ช่วยให้ทราบว่าตารางธาตุในปัจจุบันจัดธาตุเป็น หมู่และคาบโดยอาศัยสมบัติบางประการที่คล้ายกัน สมบัติของธาตุหมู่หลักตามหมู่และตามคาบซึ่ง ได้แก่ขนาดอะตอม รัศมีไอออน พลังงานไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพรรคภาพอิเล็กตรอน มีแนวโน้มเป็นดังนี้
2.4.3 ขนาดอะตอม
ตามแบบจำ ลองอะตอมแบบกลุ่มหมอก อิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลา ด้วยความเร็วสูงและไม่สามารถบอกตำ แหน่งที่แน่นอนรวมทั้งไม่สามารถกำ หนดขอบเขตที่แน่นอน ของอิเล็กตรอนได้ นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดี่ยวแต่จะมีแรงยึดเหนี่ยวระหว่าง อะตอมไว้ด้วยกัน จึงเป็นเรื่องยากที่จะวัดขนาดอะตอม (atomic radius) ที่อยู่ในภาวะอิสระหรือเป็นอะตอมเดี่ยว ในทางปฏิบัติจึงบอกขนาดอะตอมด้วย รัศมีอะตอม (atomic radius) ซึ่งกำ หนดให้ มีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวระหว่างอะตอม ไว้ด้วยกันหรือที่อยู่ชิดกัน
การศึกษารัศมีอะตอมของธาตุทำ ให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบ ขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ ตัวอย่างรัศมีอะตอมของธาตุในตาราง ธาตุซึ่งได้จากการคำ นวณ แสดงดังรูป 2.21
เมื่อพิจารณาขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันพบว่า ขนาดอะตอมมีแนวโน้มลดลง เมื่อเลขอะตอมเพิ่มขึ้น อธิบายได้ว่าเนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับ พลังงานเดียวกัน แต่มีจำ นวนโปรตอนในนิวเคลียสแตกต่างกัน ธาตุที่มีจำ นวนโปรตอนมากจะดึงดูด เวเลนซ์อิเล็กตรอนด้วยแรงที่มากกว่าธาตุที่มีจำ นวนโปรตอนน้อย เวเลนซ์อิเล็กตรอนจึงเข้าใกล้ นิวเคลียสได้มากกว่าทำ ให้อะตอมมีขนาดเล็กลง
ส่วนธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้นจำ นวนโปรตอนในนิวเคลียสและจำ นวนระดับ พลังงานที่มีอิเล็กตรอนเพิ่มขึ้นด้วย อิเล็กตรอนที่อยู่ชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่าง โปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอน ทำ ให้แรงดึงดูดต่อเวเลนซ์อิเล็กตรอนมีน้อย เป็นผลให้ ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำ นวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอน ออกไปอะตอมจะกลายเป็นไอออน การบอกขนาดของไอออนทำ ได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน (ionic radius) ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของ ไอออนคู่หนึ่ง ๆ ที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก ตัวอย่างรัศมีไอออนของ Mg² + และ O2- ในสารประกอบ MgO แสดงดังรูป 2.22 และ 2.23
รูป 2.22 รัศมีไอออนของ Mg^2+ และ O^2-
รูป 2.23 เปรียบเทียบขนาดของอะตอมกับไอออน
เมื่อโลหะทำ ปฏิกิริยากับอโลหะ อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก จำ นวนอิเล็กตรอนในอะตอมจึงลดลง ทำ ให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วย หรือกล่าวอีกนัยก็คือ แรงดึงดูดระหว่างประจุในนิวเคลียสกับอิเล็กตรอนจะเพิ่มมากขึ้น ไอออนบวกจึงมีขนาดเล็กกว่าอะตอม เดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบ เนื่องจากมี การเพิ่มขึ้นของจำ นวนอิเล็กตรอน ขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิม ไอออนลบ จึงมีขนาดใหญ่กว่าอะตอมเดิม ตัวอย่างขนาดอะตอมกับขนาดไอออนของธาตุแสดงดังรูป 2.24
รูป 2.24 รัศมีอะตอมและรัศมีไอออน (พิโกเมตร) ของธาตุบางชนิด
เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ ส่วนใหญ่มีแนวโน้มมีขนาดเพิ่มขึ้น จากบนลงล่างเช่นเดียวกับขนาดอะตอม รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอม แต่รัศมีไอออนลบ จะมีค่ามากกว่ารัศมีอะตอม
2.4.5 พลังงานไอออไนเซชัน
พลังงานปริมาณน้อยที่สุดที่ทำ ให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่า พลังงานไอออไนเซชัน (ionization energy, IE) โดยค่า IE แสดงถึงความยากง่ายในการทำ ให้อะตอมใน สถานะแก๊สกลายเป็นไอออนบวก โดย IE น้อยแสดงว่าทำ ให้เป็นไอออนบวกได้ง่ายแต่ถ้า IE มาก แสดงว่าทำ ให้เป็นไอออนบวกได้ยาก
การทำ ให้ไฮโดรเจนอะตอมในสถานะแก๊สกลายเป็นไฮโดรเจนไอออนในสถานะแก๊สเขียน แสดงได้ดังนี้
การทำให้อิเล็กตรอนหลุดออกจากอะตอมของไฮโดรเจนจะต้องใช้พลังงานอย่างน้อยที่สุด 1318 กิโลจูลต่อโมล นั่นคือพลังงานไอออไนเซชันของไฮโดรเจนอะตอมเท่ากับ 1318 กิโลจูลต่อโมล
ธาตุไฮโดรเจนมี 1 อิเล็กตรอน จึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียว ถ้าเป็นธาตุที่มีหลาย อิเล็กตรอนก็จะมีพลังงานไอออไนเซชันหลายค่า พลังงานน้อยที่สุดที่ทำ ให้อิเล็กตรอนตัวแรกหลุดออก
จากอะตอมที่อยู่ในสถานะแก๊สเรียกว่า พลังงานไอออไนเซชันลำดับที่หนึ่ง (first ionization energy) เขียนย่อเป็น IE₁ พลังงานที่ทำ ให้อิเล็กตรอนในลำ ดับต่อ ๆ มาหลุดออกจากอะตอมเรียกว่าพลังงาน ไอออไนเซชันลำ ดับที่ 2 3 … และเขียนย่อเป็น IE₂ IE₃ … ตามลำ ดับ เช่น ธาตุคาร์บอนมี6 อิเล็กตรอนจึงมีพลังงานไอออไนเซชัน 6 ค่า เขียนแสดงได้ดังต่อไปนี้
สำหรับพลังงานไอออไนเซชันของธาตุ20 ธาตุแรกเรียงตามเลขอะตอมแสดงไว้ในตาราง 2.10
ตาราง 2.10 (ขยายใหญ่เพื่อดูชัดๆ)
เมื่อเขียนกราฟแสดงความสัมพันธ์ระหว่างพลังงานไอออไนเซชันลำ ดับต่าง ๆ ของแต่ละธาตุกับ ลำ ดับที่ของพลังงานไอออไนเซชัน โดยให้แกนนอนเป็นลำ ดับที่ของพลังงานไอออไนเซชันและแกนตั้ง เป็นพลังงานไอออไนเซชันจะได้กราฟดังรูป 2.25
รูป 2.25
จากกราฟทำ ให้ทราบว่าอะตอมมีจำ นวนระดับพลังงาน และจำ นวนอิเล็กตรอนในแต่ละระดับ พลังงานของอะตอมเท่าใด ซึ่งสอดคล้องกับตาราง 2.10 การเปรียบเทียบพลังงานไอออไนเซชันของ ธาตุจะใช้เฉพาะค่าพลังงานไอออไนเซชันลำ ดับที่ 1 ซึ่งเมื่อนำ ค่าพลังงานไอออไนเซชันลำ ดับที่ 1 ของธาตุบางธาตุในตารางธาตุมาแสดงจะได้ดังนี้
รูป 2.26 ค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุบางชนิด
เมื่อพิจารณาพลังงานไอออไนเซชันลำ ดับที่ 1 ของธาตุตามคาบพบว่า มีแนวโน้มเพิ่มขึ้นตาม เลขอะตอม เนื่องจากธาตุในคาบเดียวกันมีจำ นวนโปรตอนในนิวเคลียสเพิ่มขึ้นและมีขนาดอะตอม เล็กลง แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนจึงเพิ่มมากขึ้น อิเล็กตรอนจึงหลุดออกจาก อะตอมได้ยาก
พลังงานไอออไนเซชันลำ ดับที่ 1 ของธาตุตามหมู่พบว่า มีแนวโน้มลดลงเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากระยะระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ทำ ให้แรงดึงดูดระหว่างนิวเคลียสกับ เวเลนซ์อิเล็กตรอนลดลงอิเล็กตรอนจึงหลุดจากอะตอมได้ง่ายขึ้น ดังนั้นค่าพลังงานไอออไนเซชัน จึงสามารถใช้ในการพิจารณาความยากง่ายในการเกิดเป็นไอออนบวกของอะตอมธาตุแต่ละชนิด ถ้าพลังงานไอออไนเซชันมีค่าน้อย จะเกิดเป็นไอออนบวกได้ง่าย
2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอน เรียกว่า สัมพรรคภาพอิเล็กตรอน (electron affinity, EA) เขียนสมการแสดงการเปลี่ยนแปลงได้ดังนี้
ถ้าค่าสัมพรรคภาพอิเล็กตรอนมีค่าเป็นบวก หมายความว่า อะตอมคายพลังงานเมื่อได้รับ อิเล็กตรอน แสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะรับอิเล็กตรอนได้ดี ความสามารถในการรับ อิเล็กตรอนของแต่ละธาตุมีความแตกต่างกัน ดังตัวอย่าง
จากตัวอย่างแสดงว่า อะตอม F มีแนวโน้มที่จะรับอิเล็กตรอนดีกว่า O และ P ตามลำ ดับ เมื่อ อะตอมของธาตุรับ 1 อิเล็กตรอนแล้ว การรับอิเล็กตรอนเพิ่มขึ้นอีก 1 อิเล็กตรอนจะรับได้ยากขึ้น (เกิดแรงผลักกัน) ดังนั้นค่าสัมพรรคภาพอิเล็กตรอนจึงลดลง
ค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใส่พลังงานเพิ่มเข้าไปเพื่อให้รับอิเล็กตรอนได้เพิ่ม อีก 1 อิเล็กตรอน ตัวอย่าง ค่า EA ของธาตุบางธาตุแสดงดังรูป 2.27
รูป 2.27 ค่าสัมพรรคภาพอิเล็กตรอนของธาตุบางชนิด
เมื่อพิจารณาตามคาบพบว่า ค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะ (ยกเว้นธาตุหมู่VIIIA) มีค่ามากกว่าธาตุโลหะ แสดงว่าธาตุอโลหะมีแนวโน้มที่จะรับอิเล็กตรอนได้ดีกว่าธาตุโลหะ เมื่อพิจารณา โดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มใน การรับอิเล็กตรอนได้ดีกว่าธาตุหมู่อื่น ที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่ นี้จะทำ ให้อะตอมมีการจัดเรียงอิเล็กตรอนเหมือนธาตุหมู่ VIIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี (electronegativity, EN) คือความสามารถของอะตอมในการดึงดูด อิเล็กตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสาร แนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุเป็น ดังรูป 2.28
รูป 2.28 ค่าอิเล็กโทรเนกาติวิตีของธาตุบางชนิด
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่า มีแนวโน้มเพิ่มขึ้นตามเลขอะตอม เนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุด และหมู่ VIIA มีขนาดเล็กที่สุด ความ สามารถในการดึงดูดอิเล็กตรอนตามคาบจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุ หมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำ ที่สุด ส่วนธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุด ธาตุในหมู่ เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตีลดลงเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาดของอะตอมที่ เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
จากสมบัติต่าง ๆ ของธาตุในตารางธาตุที่ได้ศึกษามาแล้ว จะพบว่าส่วนใหญ่มีการเปลี่ยนแปลง ค่อนข้างสม่ำ เสมอทำ ให้สามารถทำ นายแนวโน้มสมบัติของธาตุในตารางธาตุได้ นอกจากนี้ยังมีสมบัติ อื่น ๆ ของธาตุอีกหลายประการซึ่งต้องพิจารณาจากการเกิดสารประกอบ สมบัติดังกล่าวนั้นจะได้ศึกษา รายละเอียดในบทต่อไป
2.5 ธาตุแทรนซิชัน
นักเรียนได้ศึกษาสมบัติบางประการของธาตุหมู่ A มาแล้ว ต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่ง ซึ่งอยู่ระหว่างธาตุหมู่ IIA และหมู่ IIIA ที่เรียกว่า ธาตุแทรนซิชัน ประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มธาตุแลนทานอยด์กับกลุ่มธาตุแอกทินอยด์ ดังรูป 2.29
รูป 2.29 ธาตุแทรนซิชัน
ธาตุแทรนซิชันเหล่านี้มีอยู่ทั้งในธรรมชาติและได้จากการสังเคราะห์ บางธาตุเป็นธาตุกัมมันตรังสี ธาตุแทรนซิชันมีสมบัติอย่างไร จะได้ศึกษาต่อไป
2.5.1 สมบัติของธาตุแทรนซิชัน
นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้อยู่กลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำ ถามนี้ให้ศึกษาสมบัติของ ธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกันจากตาราง 2.11
จากตาราง 2.11 พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะหมู่หลัก ในคาบเดียวกัน เช่น มีค่าพลังงานไอออไนเซชันลำ ดับที่ 1 และอิเล็กโทรเนกาติวิตีต่ำ อย่างไรก็ตาม ธาตุแทรนซิชันมีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูงกว่าโลหะหมู่หลัก เมื่อพิจารณาขนาด อะตอมพบว่า ธาตุแทรนซิชันมีขนาดใกล้เคียงกันและมีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียม เพื่ออธิบายเกี่ยวกับขนาดอะตอมของธาตุแทรนซิชัน ให้นักเรียนพิจารณาการจัดเรียงอิเล็กตรอนของ ธาตุโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4 ในตาราง 2.12
* [Ar] แทนการจัดเรียงอิเล็กตรอนของธาตุอาร์กอนซึ่งคือ 1s² 2s² 2p⁶ 3s² 3p⁶
จากตาราง 2.12 จะเห็นได้ว่าธาตุแทรนซิชันในคาบที่ 4 ส่วนใหญ่มีจำ นวนเวเลนซ์อิเล็กตรอน เป็น 2 และมีจำ นวนอิเล็กตรอนในระดับพลังงานย่อยที่อยู่ถัดจากระดับพลังงานนอกสุดเข้าไปไม่เท่ากัน เนื่องจากอิเล็กตรอนตัวสุดท้ายบรรจุอยู่ในระดับพลังงานย่อย 3d เช่น ธาตุSc มีจำ นวนอิเล็กตรอนใน 3d เป็น 1 ธาตุTi ซึ่งอยู่ในลำ ดับถัดไปมีอิเล็กตรอนใน 3d เป็น 2 และเพิ่มขึ้นจนครบ 10 ในธาตุCu การที่มี อิเล็กตรอนเพิ่มขึ้นในออร์บิทัล 3d ซึ่งเป็นอิเล็กตรอนวงในที่สามารถกำ บังแรงดึงดูดจากนิวเคลียสที่มีต่อ อิเล็กตรอนในออร์บิทัล 4s ได้ก็ไม่ทำ ให้แรงดึงดูดต่ออิเล็กตรอนในชั้น 4s ต่างกันมากนักแม้ว่าเลขอะตอม หรือประจุในนิวเคลียสจะเพิ่มขึ้น ขนาดอะตอมของธาตุแทรนซิชันคาบที่ 4 จากซ้ายไปขวาจึงมีขนาด ลดลงเพียงเล็กน้อยและไม่แตกต่างกันอย่างชัดเจนเหมือนธาตุโพแทสเซียมและแคลเซียม นอกจากสมบัติ ต่าง ๆ ในในตาราง 2.11 และ 2.12 แล้ว โลหะหมู่หลักและโลหะแทรนซิชันยังมีสมบัติใดแตกต่างกันอีก
สารประกอบของโลหะหมู่หลักส่วนใหญ่เป็นสีขาว หรือใสไม่มีสีส่วนสารประกอบของโลหะแทรนซิชันจะมีได้หลายสีเช่น CuSO₄•5H₂O มีสีฟ้า MnO₂ มีสีเทาเกือบดำ
โลหะโซเดียมและแมกนีเซียมเป็นตัวแทนของโลหะหมู่หลักซึ่งอยู่หมู่ IA และ IIA ตามลำ ดับ เมื่อนำ ธาตุทั้งสองทำ ปฏิกิริยาเคมีกับน้ำ พบว่าที่อุณหภูมิห้อง โลหะโซเดียมทำ ปฏิกิริยากับน้ำ ได้เร็วและรุนแรง ส่วนแมกนีเซียมเกิดปฏิกิริยาได้ค่อนข้างช้าแต่จะเกิดปฏิกิริยาได้เร็วขึ้น ในน้ำ ร้อน สารละลายที่ได้มีสมบัติเป็นเบสซึ่งสังเกตได้จากการเปลี่ยนสีของฟีนอล์ฟทาลีน และมีแก๊ส เกิดขึ้นซึ่งถ้าทดสอบแก๊สที่เกิดขึ้นจะพบว่าเป็นแก๊สไฮโดรเจน เขียนสมการแสดงปฏิกิริยาเคมีที่เกิด ขึ้นได้ดังนี้
รูป 2.30 ปฏิกิริยาของโลหะหมู่หลักกับน้ำ
สำหรับโลหะทองแดงและสังกะสีซึ่งเป็นตัวแทนของธาตุแทรนซิชันเมื่อใส่ลงไปในน้ำ ที่ อุณหภูมิห้องพบว่าไม่มีปฏิกิริยาเคมีเกิดขึ้น ซึ่งสามารถกล่าวได้ว่าธาตุแทรนซิชันทำ ปฏิกิริยาเคมีกับน้ำได้ช้ากว่าธาตุหมู่หลัก
2.6 ธาตุกัมมันตรังสี
ธาตุอีกกลุ่มหนึ่งในตารางธาตุซึ่งมีสมบัติแตกต่างจากธาตุที่เคยศึกษามาแล้วคือ สามารถแผ่รังสี แล้วกลายเป็นอะตอมของธาตุใหม่ได้นักเรียนคิดว่าการเปลี่ยนแปลงเหล่านี้เกิดขึ้นได้อย่างไร
ในปีพ.ศ. 2439 อองตวน อองรีแบ็กเกอเรล (Antoine Henri Becquerel) นักวิทยาศาสตร์ ชาวฝรั่งเศสพบว่า เมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำ ไว้กับสารประกอบของยูเรเนียม แผ่น ฟิล์มจะมีลักษณะเหมือนถูกแสง และเมื่อทำ การทดลองกับสารประกอบของยูเรเนียมชนิดอื่น ๆ ก็ได้ ผลเช่นเดียวกัน จึงสรุปว่าน่าจะมีรังสีแผ่ออกมาจากธาตุยูเรเนียม
ต่อมาปีแอร์กูรีและมารีกูรี(Pierre Curie และ Marie Curie) ได้ค้นพบว่า ธาตุพอโลเนียม เรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกัน ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง เรียกว่า กัมมันตภาพรังสี (radioactivity) ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ ไม่เสถียร และไอโซโทปของธาตุที่สามารถแผ่รังสีได้เองอย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสี (radioactive isotope) หรือสารกัมมันตรังสี(radioactive substance) เช่น carbon-14 (C-14) สำ หรับธาตุที่ทุกไอโซโทปเป็นไอโซโทปกัมมันตรังสีจะเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี (radioactive element) ธาตุกัมมันตรังสีส่วนใหญ่มีเลขอะตอมสูงกว่า 83 เช่น U-238 U-235 Th-232 Rn-222 ในธรรมชาติพบธาตุกัมมันตรังสีหลายชนิด นอกจากนี้นักวิทยาศาสตร์ยังสังเคราะห์ธาตุ กัมมันตรังสีขึ้นเพื่อใช้ประโยชน์ในด้านต่าง ๆ
2.6.1 การเกิดกัมมันตภาพรังสี
กัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงาน สูงมากและไม่เสถียร จึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสี จากการศึกษาของ นักวิทยาศาสตร์แสดงให้เห็นว่า รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟา (alpha ray) รังสีบีตา (beta ray) หรือแกมมา (gamma ray) ดังรูป 2.31
รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสี เช่น รังสีแอลฟา บีตา แกมมา มีสมบัติเป็นอย่างไร ศึกษาได้จากตาราง 2.13
รังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีนอกจากรังสีแอลฟา บีตา แกมมา แล้วยังมีรังสีชนิดอื่น ๆ เช่น โพซิตรอน (β+ ) สัญลักษณ์คือ +₁⁰e โปรตอน (p) สัญลักษณ์คือ ¹₁H
ดิวเทอรอน (D) สัญลักษณ์คือ ²₁H ทริทอน (T) สัญลักษณ์คือ ³₁H นิวตรอน (n) สัญลักษณ์คือ ₀¹n
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
จากการศึกษาไอโซโทปของธาตุจำ นวนมากทำ ให้ได้ข้อสังเกตว่า ไอโซโทปของนิวเคลียสที่มี อัตราส่วนระหว่างจำ นวนนิวตรอนต่อจำ นวนโปรตอนไม่เหมาะสมคือนิวเคลียสที่มีจำ นวนนิวตรอน แตกต่างจากจำ นวนโปรตอนมากเกินไปจะไม่เสถียร จึงเกิดการเปลี่ยนแปลงภายในนิวเคลียสโดย การแผ่รังสี(radiation) ออกมาแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่า ดังตัวอย่างต่อไปนี้
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดกับนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำ นวนนิวตรอน ต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมาจะกลายเป็นนิวเคลียสของธาตุใหม่ที่ เสถียรซึ่งมีเลขอะตอมลดลง 2 และเลขมวลลดลง 4 ดังตัวอย่าง
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำ นวนนิวตรอนมากกว่าโปรตอนมาก นิวตรอนในนิวเคลียส จะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอน ซึ่งอิเล็กตรอนจะถูกปลดปล่อยออกจากนิวเคลียสในรูปของ รังสีบีตาและนิวเคลียสใหม่จะมีเลขอะตอมเพิ่มขึ้น 1 โดยที่เลขมวลยังคงเดิม ดังตัวอย่าง
การแผ่รังสีแกมมา เกิดกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมาก หรือไอโซโทปที่สลายตัวให้ รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลง ในนิวเคลียสเพื่อให้มีพลังงานต่ำ ลง โดยปล่อยพลังงานส่วนเกินออกมาเป็นรังสีแกมมา ดังตัวอย่าง
ชนิดของรังสีที่ไอโซโทปกัมมันตรังสีหรือธาตุกัมมันตรังสีปลดปล่อยออกมา สามารถพิจารณา ได้จากกราฟในรูป 2.32
รูป 2.32 เขตเสถียรภาพของไอโซโทปของธาตุและชนิดของรังสีที่แผ่นอกเขตเสถียรภาพ
จากรูป 2.32 แถบที่แรเงาแทนแถบเสถียรภาพ (belt of stability) จุดสีดำ แทนไอโซโทปของ ธาตุที่เสถียร ซึ่งจากรูปจะเห็นว่าธาตุที่มีจำ นวนโปรตอน (เลขอะตอม) มากกว่า 83 ไม่มีไอโซโทปที่ เสถียร ไอโซโทปที่ไม่เสถียรเหล่านี้มีแนวโน้มที่จะปล่อยรังสีแอลฟาเพื่อเกิดเป็นไอโซโทปใหม่ที่มี จำ นวนโปรตอนและนิวตรอนลดลง สำ หรับไอโซโทปที่มีสัดส่วนของนิวตรอนต่อโปรตอนมากเกินไป (แถบสีเขียว) มีแนวโน้มแผ่รังสีบีตาเพราะเมื่อปล่อยรังสีบีตาออกมาจะเกิดเป็นไอโซโทปใหม่ที่มี จำ นวนโปรตอนเพิ่มขึ้นแต่จำ นวนจำ นวนนิวตรอนลดลง (เลขมวลเท่าเดิม) ในขณะที่ไอโซโทปที่มี สัดส่วนของนิวตรอนต่อโปรตอนน้อยเกินไป (แถบสีเหลือง) จะมีแนวโน้มแผ่รังสีโพซิตรอน ซึ่งจะ ทำ ให้ไอโซโทปที่เกิดขึ้นมีจำ นวนโปรตอนลดลงแต่นิวตรอนเพิ่มขึ้น (เลขมวลเท่าเดิม)
นิวเคลียสของไอโซโทปกัมมันตรังสีสามารถสลายตัวและแผ่รังสีได้ตลอดเวลาโดยไม่ขึ้นกับ อุณหภูมิหรือความดัน การสลายตัวและแผ่รังสีของไอโซโทปกัมมันตรังสีจะเป็นสัดส่วนโดยตรงกับ จำ นวนอนุภาคในนิวเคลียสกัมมันตรังสีนั้น
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรต่าง ๆ ในชีวิตประจำ วันทั้งการรับประทานอาหาร การดื่มน้ำ การหายใจ ล้วนมีโอกาส ที่มนุษย์จะได้รับรังสีจากไอโซโทปกัมมันตรังสีเช่น K-40 C-14 Ra-226 เข้าสู่ร่างกาย นอกจากนี้ ยังได้รับรังสีคอสมิก (cosmic ray) ซึ่งส่วนใหญ่มาจากอวกาศ รังสีต่าง ๆ เหล่านี้มีแหล่งกำ เนิดจาก ธรรมชาตินอกจากนี้บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมา เช่น รังสีจากเครื่องเอกซเรย์รังสีจาก โรงไฟฟ้านิวเคลียร์
รูป 2.33 ปริมาณรังสีที่ได้รับในแต่ละวันโดยประมาณ
แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำ วัน แต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์ สร้างขึ้นในปริมาณเพียงเล็กน้อย โดยน้อยกว่า 100 มิลลิซีเวิร์ตพบว่า เซลล์เนื้อเยื่อสามารถฟื้นตัวได้ แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำ ให้ เกิดความเสี่ยงต่อสุขภาพ เช่น คลื่นไส้ อาเจียน ปวดศีรษะ เป็นมะเร็ง โรคทางพันธุกรรม ต้อแก้วตา การได้รับรังสีปริมาณมากทั่วร่างกายในเวลาสั้น ๆ สามารถทำ ให้เสียชีวิตได้
สำหรับหน่วยงานที่ทำ งานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสี(radiation symbol) ลงบน ฉลากของภาชนะหรือเครื่องมือรวมทั้งบริเวณใกล้เคียง เพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสี ใช้เป็นมาตรฐานจะเป็นรูปใบพัด 3 แฉก มีสีม่วงอ่อน ม่วงเข้ม หรือสีดำ บนพื้นสีเหลือง ดังรูป 2.34
รูป 2.34 สัญลักษณ์รังสี
เนื่องจากสัญลักษณ์รังสีดังรูป 2.34 อาจสื่อความหมายไม่ชัดเจนหรือบุคคลที่ไม่เกี่ยวข้องอาจ ไม่เข้าใจความหมาย ดังนั้นทบวงปรมาณูระหว่างประเทศ (International Atomic Energy Agency หรือ IAEA) และองค์กรระหว่างประเทศว่าด้วยมาตรฐาน (International Organization for Standardization หรือ ISO) ได้ออกแบบสัญลักษณ์ใหม่เป็นรูปคลื่นของรังสีกะโหลกไขว้และคนกำ ลังวิ่ง ดังรูป 2.35 โดยมีการประกาศใช้เมื่อวันที่ 15 กุมภาพันธ์ 2550
รูป 2.35 สัญลักษณ์รังสีแบบใหม
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ไอโซโทปกัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออกมาได้เองตลอดเวลา ไอโซโทป กัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกัน อัตราการสลายตัวของไอโซโทปกัมมันตรังสี จะบอกเป็น ครึ่งชีวิต (half life) ใช้สัญลักษณ์t₁/₂ โดยหมายถึง ระยะเวลาที่นิวเคลียสของไอโซโทป กัมมันตรังสีสลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม ไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่ง ๆ จะมี ครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ เช่น Na-24 มีครึ่งชีวิต 15 ชั่วโมง หมายความว่าถ้าเริ่มต้นมีNa-24 ปริมาณ 10 กรัม นิวเคลียสนี้จะสลายตัวให้รังสีออกมาจน กระทั่งเวลาผ่านไปครบ 15 ชั่วโมง จะมีNa-24 เหลืออยู่ 5 กรัม และเมื่อเวลาผ่านไปอีก 15 ชั่วโมง จะมีNa-24 เหลืออยู่ 2.5 กรัม นั่นคือเวลาผ่านไปทุก ๆ 15 ชั่วโมง Na-24 จะสลายตัวไปเหลือเพียง ครึ่งหนึ่งของปริมาณเดิม เขียนแสดงได้ดังรูป 2.36
รูป 2.36 แสดงปริมาณของ Na-24 ที่ลดลงครึ่งหนึ่งทุก ๆ 15 ชั่วโมง
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการสลายตัว ของไอโซโทปกัมมันตรังสีแต่ละชนิดได้ ตัวอย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด แสดงดัง ตาราง 2.14
ระยะเวลาที่แสดงถึงครึ่งชีวิตของไอโซโทปกัมมันตรังสีสามารถนำ ไปใช้คำ นวณหาปริมาณของ ไอโซโทปกัมมันตรังสีในระยะเวลาต่าง ๆ กันได้ดังตัวอย่างต่อไปนี้
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีอาจเกิดจากการ แตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่ หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มี ขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่ รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็น จำนวนมหาศาล ซึ่งสามารถนำ มาใช้ประโยชน์ได้
ในปีพ.ศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียสของ U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า เช่น
กระบวนการที่นิวเคลียสของไอโซโทปของธาตุหนักบางชนิด แตกออกเป็นไอโซโทปของธาตุที่ เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ฟิชชัน (fission) ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชัน ได้เช่น U-238 หรือ Pu-239 การเกิดฟิชชันแต่ละครั้งจะคายพลังงานออกมาจำ นวนมากและได้ ไอโซโทปกัมมันตรังสีหลายชนิด จึงถือได้ว่าฟิชชันเป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำ คัญ นอกจาก นี้ฟิชชันยังได้นิวตรอนเกิดขึ้นด้วย ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่น ๆ จะเกิด ฟิชชันต่อ เนื่องไปเรื่อย ๆ เรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่ (chain reaction) ดังรูป 2.37
รูป 2.37 แสดงปริมาณของ Na-24 ที่ลดลงครึ่งหนึ่งทุก ๆ 15 ชั่วโมง
ฟิชชันที่เกิดขึ้นภายใต้ภาวะที่เหมาะสม จะได้จำ นวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็ว ทำ ให้ฟิชชัน ดำ เนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาจำ นวนมหาศาล ถ้าไม่สามารถควบคุมปฏิกิริยาได้ อาจเกิดการระเบิดอย่างรุนแรง หลักการของการเกิดปฏิกิริยาลูกโซ่ได้นำ มาใช้ในการทำ ระเบิดปรมาณู การควบคุมฟิชชันทำ ได้หลายวิธี เช่น ควบคุมมวลของสารตั้งต้นให้น้อยลงเพื่อให้จำ นวนนิวตรอนที่ เกิดขึ้นมีไม่เพียงพอ7ที่จะทำ ให้เกิดปฏิกิริยาลูกโซ่ได้หรือใช้โลหะแคดเมียมและโบรอนจับนิวตรอน บางส่วนไว้เพื่อลดจำ นวนนิวตรอนที่เกิดขึ้น ปัจจุบันนักวิทยาศาสตร์นำ ฟิชชันมาใช้ประโยชน์อย่าง กว้างขวาง เช่น ใช้ผลิตไอโซโทปกัมมันตรังสีในเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการเกษตร การแพทย์ และอุตสาหกรรม ใช้ผลิตกระแสไฟฟ้าในโรงไฟฟ้าปรมาณู
ในกรณีที่นิวเคลียสของธาตุเบาสองชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมากดังตัวอย่าง
กระบวนการนี้เรียกว่า ฟิวชัน (fusion) ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยาเดียวกับที่เกิดขึ้นบน ดวงอาทิตย์ การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมาก เพื่อเอาชนะแรงผลักระหว่างนิวเคลียส ที่จะเข้ารวมกัน ซึ่งประมาณกันว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้ อาจได้จากฟิชชันซึ่งเปรียบเสมือนเป็นชนวนที่ทำ ให้เกิดฟิวชัน ถ้าพลังงานที่ปล่อยออกมาจากฟิวชัน เกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรง แต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่าง ช้า ๆ และต่อเนื่องจะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ ฟิวชันมีข้อได้เปรียบกว่าฟิชชัน หลายประการกล่าวคือ คายพลังงานออกมามาก สารตั้งต้นของฟิวชันหาได้ง่ายและมีปริมาณมาก นอกจากนี้ผลิตภัณฑ์ที่เกิดจากฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่า ผลิตภัณฑ์จากฟิชชัน
แม้จะมีการค้นพบกระบวนการฟิวชันมานานแต่การนำ มาใช้อย่างเป็นรูปธรรมเป็นไปได้ยาก เพราะการเกิดฟิวชันต้องใช้อุณหภูมิสูงมาก ซึ่งที่สภาวะนี้สารจะเปลี่ยนรูปเป็นพลาสมา (plasma) ซึ่งไม่เสถียร ดังนั้นการควบคุมกระบวนการฟิวชันให้เกิดขึ้นอย่างต่อเนื่องเป็นไปได้ยากมาก
ตัวอย่างของการพยายามนำ ความรู้เรื่องฟิวชันมาใช้ประโยชน์ เช่น การสร้างโทคาแมค (tokamak) ขนาดใหญ่ภายใต้โครงการผลิตเครื่องปฏิกรณ์นิวเคลียร์ฟิวชันซึ่งเป็นความร่วมมือกันในระดับ นานาชาติมีสมาชิกหลักคือ สหรัฐอเมริกา ยุโรป รัสเซีย จีน ญี่ปุ่น และ เกาหลีใต้โครงการนี้มี วัตถุประสงค์เพื่อสร้างต้นแบบของโรงผลิตพลังงานไฟฟ้าโดยใช้ฟิวชัน
2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
สารกัมมันตรังสีแต่ละชนิดมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกัน การนำ สารกัมมันตรังสี มาใช้ประโยชน์จึงแตกต่างกันดังตัวอย่าง
ด้านธรณีวิทยา ใช้C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ ประกอบ เช่น ไม้กระดูก สารอินทรีย์ต่าง ๆ การหาอายุวัตถุโบราณโดยการวัดปริมาณของ C-14 อธิบายได้ว่า ในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก ดังปฏิกิริยา
ในอากาศจึงมีทั้งคาร์บอนในรูปของ C-12 และ C-14 เมื่อคาร์บอนทำ ปฏิกิริยากับออกซิเจนใน อากาศเกิดเป็นแก๊สคาร์บอนไดออกไซด์จึงพบทั้งในรูปของ ¹²CO₂ ปนอยู่กับ ¹⁴CO₂ ซึ่งพืชจะนำ ไปใช้ในกระบวนการสังเคราะห์ด้วยแสง เมื่อสัตว์กินพืชเหล่านั้นเป็นอาหาร C-14 จะเข้าสู่ร่างกาย ของสัตว์ทำ ให้พบ C-14 ได้ทั้งในพืชและสัตว์ ขณะที่พืชหรือสัตว์ยังมีชีวิตอยู่ ¹⁴CO₂ จะถูกรับเข้า และขับออกตลอดเวลา เป็นผลให้C-14 ในสิ่งมีชีวิตมีความเข้มข้นคงที่หรือกล่าวว่าสัดส่วนระหว่าง C-14 ต่อ C-12 มีค่าคงที่ เมื่อสิ่งมีชีวิตตาย การรับ C-14 เข้าสู่ร่างกายจะสิ้นสุดลง แต่การสลายตัวยัง เกิดขึ้นต่อไป จึงทำ ให้มีปริมาณ C-14 หรือสัดส่วนระหว่าง C–14 ต่อ C–12 ลดลงเรื่อย ๆ ดังนั้นถ้า ทราบสัดส่วนระหว่าง C-14 ต่อ C-12 ในขณะที่ยังมีชีวิตอยู่และวัดปริมาณของ C–14 ในขณะที่นำ มาศึกษาได้ก็สามารถทำ นายอายุได้ เช่น สมมติว่าพบซากไม้โบราณชิ้นหนึ่งมีอัตราการสลายตัวของ C–14 ลดลงไปครึ่งหนึ่งจากของเดิมขณะที่ยังมีชีวิตอยู่ก็อาจสรุปได้ว่า ไม้ชิ้นนั้นตายมาแล้วเท่ากับ ครึ่งชีวิตของ C–14 หรือมีอายุประมาณ 5730 ปี
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่าง ๆ ในร่างกาย โดยให้คนไข้รับประทาน อาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำ นวนเล็กน้อย จากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตาม ดูผลการดูดซึมไอโซโทปกัมมันตรังสีของระบบอวัยวะต่าง ๆ เช่น ให้ดื่มสารละลาย I–131 แล้ว ติดตามดูความผิดปกติของต่อมไทรอยด์ ใช้I–132 ติดตามดูภาพสมอง ฉีด Na–24 เข้าเส้นเลือด โดยตรงเพื่อดูระบบการไหลเวียนของเลือด รับประทาน Tc–99 เมื่อต้องการดูภาพหัวใจ ตับ ปอด นอกจากนี้แพทย์ยังใช้ไอโซโทปกัมมันตรังสีรักษาโรคโดยตรง เช่น ใช้Co–60 หรือ Ra–226 ในการ รักษาโรคมะเร็ง
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช โดย เริ่มต้นจากการดูดซึมที่รากจนถึงการคายออกที่ใบ หรือจำ นวนแร่ธาตุที่พืชสะสมไว้ที่ใบ เช่น ใช้P–32 จำ นวนเล็กน้อยผสมกับฟอสฟอรัสที่ไม่มีรังสีเพื่อทำ ปุ๋ย แล้วใช้เครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ ตรวจวัดรังสีที่ใบของพืช ใช้รังสีเพื่อการปรับปรุงเมล็ดพันธุ์พืชให้ได้พันธุกรรมตามต้องการโดยการนำ เมล็ดพันธุ์พืชมาอาบรังสีนิวตรอนในปริมาณและระยะเวลาที่เหมาะสมจะทำ ให้เกิดการกลายพันธุ์ได้
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่าง เช่น ใช้ตรวจหารอยตำ หนิใน โลหะหรือรอยรั่วของท่อขนส่งของเหลว โดยผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไป ตามท่อ แล้วติดตามการแผ่รังสีด้วยเครื่องไกเกอร์มึลเลอร์เคาน์เตอร์ถ้าบริเวณใดที่เครื่องมีสัญญาณ จำ นวนนับมากผิดปกติแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น ใช้วัดความหนาของวัตถุเนื่องจากรังสี แต่ละชนิดทะลุทะลวงวัตถุได้ดีไม่เท่ากัน ดังนั้นเมื่อผ่านรังสีไปยังแผ่นวัตถุต่าง ๆ เช่น โลหะ กระดาษ พลาสติก แล้ววัดความสามารถในการดูดซับรังสีของวัตถุนั้นด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ เปรียบเทียบจำ นวนนับกับตารางข้อมูลก็จะทำ ให้ทราบความหนาของวัตถุได้
ในอุตสาหกรรมการทำ อัญมณีใช้รังสีเพื่อทำ ให้อัญมณีมีสีสันสวยงามขึ้น โดยใช้รังสีแกมมา นิวตรอน หรืออิเล็กตรอนพลังงานสูงฉายไปบนอัญมณี จะทำ ให้สารที่ทำ ให้เกิดสีบนอัญมณีเปลี่ยนสี ไปได้ อัญมณีที่ฉายด้วยรังสีแกมมาจะไม่มีรังสีตกค้างแต่การอาบด้วยรังสีนิวตรอนจะมีไอโซโทป กัมมันตรังสีเกิดขึ้น จึงต้องปล่อยให้ไอโซโทปกัมมันตรังสีสลายตัวจนมีระดับรังสีที่ปลอดภัยจึงนำ มาใช้ประโยชน์
การเก็บถนอมอาหาร ใช้ Co–60 ซึ่งจะให้รังสีแกมมาที่ไม่มีผลตกค้างและรังสีจะทำ ลาย แบคทีเรีย จึงช่วยเก็บรักษาอาหารไว้ได้นานหลายวันหลังจากการผ่านรังสีเข้าไปในอาหารแล้ว
จะเห็นได้ว่าไอโซโทปกัมมันตรังสีให้ประโยชน์ต่อมนุษย์อย่างมาก แต่ถ้าใช้ในปริมาณไม่ถูกต้อง หรือนำไปใช้ในสภาพไม่เหมาะสมก็จะมีผลต่อสิ่งมีชีวิตและสิ่งแวดล้อมได้
2.7 การนำธาตุไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิต
มนุษย์นำธาตุมาใช้ประโยชน์ตั้งแต่อดีตกาล เช่น นำทองคำมาทำเครื่องประดับ นำเหล็กมาทำมีด นำ ทองแดงมาทำภาชนะเครื่องใช้ในปัจจุบันมีการค้นพบและศึกษาสมบัติของธาตุมากขึ้นจึง มีการนำธาตุมาใช้ประโยชน์ได้หลากหลายมากขึ้น ในหัวข้อนี้นักเรียนจะได้เรียนรู้เกี่ยวกับประโยชน์ ของธาตุบางชนิด รวมทั้งศึกษาถึงผลกระทบที่มีต่อสิ่งมีชีวิตและสิ่งแวดล้อม
2.7.1 ประโยชน์ของธาตุ
การจำ แนกธาตุออกเป็นกลุ่มนอกจากจะช่วยให้ง่ายต่อการศึกษาสมบัติของธาตุแล้ว ยังง่าย ต่อการพิจารณาสมบัติที่เหมาะสมในการนำ ไปประยุกต์ใช้งานได้อีกด้วย ตัวอย่างการใช้ประโยชน์ จากธาตุดังนี้
ธาตุโลหะมีสมบัติการนำ ความร้อนและนำ ไฟฟ้าได้ดีจึงนิยมนำ มาทำ เป็นอุปกรณ์ไฟฟ้า เช่น นำ ทองแดงมาทำ สายไฟฟ้า นำ สังกะสีมาทำ ขั้วไฟฟ้าของถ่านไฟฉาย นำ ลิเทียมมาทำ ขั้วไฟฟ้าใน แบตเตอรี่ลิเทียม นำ โซเดียมมาเป็นตัวกลางแลกเปลี่ยนความร้อนและหล่อเย็นในปฏิกรณ์นิวเคลียร์
ธาตุกึ่งโลหะ เช่น ซิลิคอน เจอร์เมเนียม มีสมบัติก้ำ กึ่งระหว่างสมบัติของโลหะกับอโลหะ เช่น นำ ไฟฟ้าได้แต่นำ ได้ไม่ดี นิยมนำ มาทำ เป็นสารกึ่งตัวนำ (semiconductors) ซึ่งมีสมบัติในการนำ ไฟฟ้าอยู่ระหว่างตัวนำ และฉนวนเพื่อใช้เป็นวัสดุทำ อุปกรณ์อิเล็กทรอนิกส์ต่าง ๆ
ธาตุหมู่ 18 หรือ VIIIA เป็นธาตุที่เฉื่อยต่อการเกิดปฏิกิริยาจึงนำ มาใช้ประโยชน์ตามสมบัติ ของแก๊สมีสกุล เช่น นำ ฮีเลียมซึ่งมีความหนาแน่นน้อยกว่าอากาศมาบรรจุในบอลลูนและเรือเหาะ แทนแก๊สไฮโดรเจน เนื่องจากแก๊สฮีเลียมไม่ติดไฟเหมือนแก๊สไฮโดรเจน นำ อาร์กอนมาเป็นแก๊ส บรรจุในหลอดไฟเพื่อให้ไส้หลอดมีอายุการใช้งานที่นานขึ้น ทั้งนี้เพราะอาร์กอนไม่ทำ ปฏิกิริยากับไส้ หลอดขณะที่ร้อน
สำ หรับธาตุที่มีไอโซโทปกัมมันตรังสี สามารถนำ มาใช้ประโยชน์ได้ดังที่กล่าวไว้แล้วในหัวข้อ 2.6.6 แม้ธาตุที่อยู่ในกลุ่มเดียวกันจะมีสมบัติคล้ายกัน แต่ธาตุทุกชนิดยังมีสมบัติเฉพาะตัวที่แตก ต่างกันด้วย ดังนั้นการนำ ไปใช้ประโยชน์จึงมีความจำ เพาะแตกต่างกัน การที่ธาตุแต่ละชนิดมีสมบัติ เฉพาะตัวแตกต่างกันทำ ให้บางครั้งนักวิทยาศาสตร์ต้องนำ ธาตุมากกว่า 1 ชนิดมาละลายหรือผสมกัน เพื่อให้มีสมบัติตามที่ต้องการและนำ ไปใช้ประโยชน์ได้หลากหลายมากขึ้น เช่น นำ เหล็กมาผสมกับ โครเมียมเพื่อป้องกันไม่ให้เหล็กเป็นสนิมจึงทนต่อการผุกร่อนมากขึ้น
เพื่อให้นักเรียนมีความรู้เกี่ยวกับตัวอย่างของการนำ ธาตุไปใช้ประโยชน์มากขึ้น ให้ทำ กิจกรรม 2.6 ซึ่งในกิจกรรมนี้นักเรียนต้องศึกษาข้อมูลที่กำ หนดให้ และทำ นายว่าข้อมูลการใช้ประโยชน์ที่ กำ หนดให้น่าจะเป็นการใช้ประโยชน์ของธาตุใด
2.7.2 ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
จากความรู้เดิมนักเรียนคงทราบมาแล้วว่า ธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น ตะกั่วได้ถูกใช้ในอุตสาหกรรมการผลิตแบตเตอรี่ โลหะบัดกรีอิเล็กทรอนิกส์ อุตสาหกรรมสีหรือ ใช้เคลือบภาชนะ การปนเปื้อนของตะกั่วทั้งในดิน น้ำ และอากาศ ล้วนส่งผลกระทบต่อสิ่งมีชีวิต เช่น ถ้าตะกั่วปนเปื้อนในน้ำ อาจส่งผลต่อระบบการเจริญพันธุ์ ระบบโลหิตและระบบประสาทของสัตว์ใน แหล่งน้ำ นั้น มนุษย์สามารถนำ ตะกั่วเข้าสู่ร่างกายได้3 ทาง คือ การบริโภค การหายใจ และทางผิวหนัง เมื่อตะกั่วเข้าไปสะสมในร่างกายจะทำ ให้มีอาการอ่อนเพลีย ปวดท้อง ท้องอืด เบื่ออาหาร ปวดกล้าม เนื้อ ปวดกระดูกและข้อ ความดันโลหิตสูง โลหิตจาง ความจำ เสื่อม ภูมิต้านทานลดลง และขัดขวาง การทำ งานของเอนไซม์ในร่างกาย
มนุษย์นำแคดเมียมมาใช้ในอุตสาหกรรมผลิตอุปกรณ์ไฟฟ้า โลหะผสม แบตเตอรี่ อะไหล่ รถยนต์ การชุบโลหะ แคดเมียมที่ปนเปื้อนในน้ำ อากาศ อาหาร พืชผลทางการเกษตร เช่นในใบ ยาสูบเมื่อเข้าสู่ร่างกายจะส่งผลให้ไตทำ งานผิดปกติ เกิดโรคความดันโลหิตสูง ปวดกระดูกสันหลัง ทำ ให้กระดูกผุหรือเป็นโรคมะเร็งได้
ในอดีตเคยมีการนำแก๊สไฮโดรเจนมาบรรจุในลูกโป่งสวรรค์หรือเรือเหาะ ซึ่งการกระทำ ดังกล่าวนี้ส่ง ผลให้เกิดอุบัติเหตุมีผู้ได้รับบาดเจ็บสาหัสหลายคน ที่เป็นเช่นนี้เพราะแก๊สไฮโดรเจนเป็นแก๊สที่ติดไฟได้ ซึ่งเมื่อได้รับประกายไฟจึงเกิดระเบิดเป็นเพลิงลุกไหม้ได้ตัวอย่างอุบัติเหตุ เช่น ข่าวเพลิงไหม้เรือเหาะ ไฮเดนเบิร์กของเยอรมันในวันงดสูบบุหรี่โลก ข่าวไฟไหม้ในงานชกมวยที่ประเทศไทยเนื่องจากการนำ ลูกโป่งสวรรค์หลายร้อยลูกมาประดับ จากตัวอย่างที่กล่าวมาแสดงให้เห็นว่าการนำ ธาตุมาใช้ล้วนส่ง ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม ธาตุบางชนิดแม้ไม่ได้มีสมบัติเป็นพิษร้ายแรงแต่การนำ มาใช้ไม่ ถูกวิธีก็ส่งผลให้เกิดความเสียหายต่อชีวิตและทรัพย์สินได้เช่นกัน
สรุปเนื้อหาภายในบทเรียน
นักวิทยาศาสตร์ศึกษาโครงสร้างของอะตอมด้วยการศึกษาข้อมูลและทำ การทดลอง จนสามารถเสนอแบบจำ ลองอะตอมแบบต่าง ๆ ตามข้อมูลที่ค้นพบมากขึ้น แบบจำ ลองอะตอม มีวิวัฒนาการโดยเริ่มจากดอลตันเสนอว่าธาตุประกอบด้วยอะตอมซึ่งเป็นอนุภาคขนาดเล็ก ไม่สามารถแบ่งแยกได้ ต่อมาทอมสันเสนอว่า อะตอมเป็นทรงกลมที่เป็นประจุบวกและ มีอิเล็กตรอนกระจายอยู่ทั่วไป รัทเทอร์ฟอร์ดเสนอว่า อะตอมประกอบด้วยนิวเคลียส ที่มีขนาดเล็กมากอยู่ตรงกลาง โดยมีอิเล็กตรอนวิ่งอยู่รอบ ๆ โบร์เสนอว่า อิเล็กตรอน เคลื่อนที่รอบนิวเคลียสเป็นวงและแต่ละวงมีระดับพลังงานเฉพาะตัว ต่อมานักวิทยาศาสตร์ ได้ศึกษาค้นคว้าเพิ่มเติมและเสนอแบบจำ ลองอะตอมแบบกลุ่มหมอกซึ่งแสดงโอกาสการพบ อิเล็กตรอนรอบนิวเคลียส
จากการศึกษาโครงสร้างอะตอมทำ ให้ทราบว่าโปรตอน อิเล็กตรอน และนิวตรอนเป็น อนุภาคในอะตอม โดยนิวตรอนอยู่ร่วมกับโปรตอนในนิวเคลียส (ยกเว้นอะตอมไฮโดรเจน ที่ไม่มีนิวตรอน) จำ นวนอนุภาคในอะตอมสามารถเขียนแสดงได้ด้วยสัญลักษณ์นิวเคลียร์ซึ่ง ประกอบด้วยสัญลักษณ์ธาตุ จำ นวนโปรตอนในอะตอมธาตุที่เรียกว่าเลขอะตอม และผลรวม ของจำ นวนโปรตอนและนิวตรอนในอะตอมธาตุที่เรียกว่าเลขมวล โดยธาตุต่างชนิดกันมี เลขอะตอมต่างกัน ส่วนธาตุชนิดเดียวกันที่เลขมวลไม่เท่ากันเรียกว่า ไอโซโทป อิเล็กตรอนใน อะตอมจะจัดเรียงอยู่รอบ ๆ นิวเคลียสในระดับพลังงานหลักต่าง ๆ และแต่ละระดับพลังงาน หลักยังแบ่งเป็นระดับพลังงานย่อยแตกต่างกันบริเวณที่มีโอกาสพบอิเล็กตรอนเรียกว่า ออร์บิทัล แต่ละออร์บิทัลบรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน ในสถานะพื้นอิเล็กตรอนจะจัดเรียงอยู่ ในออร์บัลที่มีระดับพลังงานต่ำ ที่สุด
สมบัติของธาตุที่มีทั้งคล้ายกันและแตกต่างกันสามารถนำ มาใช้จำ แนกธาตุเป็นกลุ่ม จนเกิดเป็นตารางธาตุในปัจจุบันซึ่งจัดเรียงธาตุตามเลขอะตอมและสมบัติที่คล้ายคลึง กันเป็นหมู่และคาบ ธาตุในตารางธาตุอาจแบ่งเป็นกลุ่มธาตุโลหะ กึ่งโลหะ และอโลหะ หรือธาตุหมู่หลัก และกลุ่มธาตุแทรนซิชัน ธาตุหมู่หลักหรือธาตุเรพรีเซนเททีฟหรือใน หมู่เดียวกันมีจำ นวนเวเลนซ์อิเล็กตรอนเท่ากัน และธาตุที่อยู่ในคาบเดียวกันมีเวเลนซ์ อิเล็กตรอนในระดับพลังงานหลักเดียวกัน ธาตุหมู่หลักมีสมบัติทางเคมีคล้ายกันตามหมู่ และมีแนวโน้มสมบัติบางประการเป็นไปตามหมู่และตามคาบ เช่น ขนาดอะตอม รัศมี ไอออน พลังงานไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพรรคภาพอิเล็กตรอน ธาตุแทรนซิชัน เป็นโลหะที่ส่วนใหญ่มีเวเลนซ์อิเล็กตรอนเท่ากับ 2 มีขนาดอะตอมใกล้เคียงกัน และมีจุดเดือด จุดหลอมเหลว และความหนาแน่นสูง เกิดปฏิกิริยากับน้ำ ได้ช้ากว่าธาตุโลหะใน กลุ่มธาตุหมู่หลัก และเมื่อเกิดเป็นสารประกอบส่วนใหญ่จะมีสี
ธาตุในธรรมชาติบางธาตุมีไอโซโทปที่แผ่รังสีได้เรียกว่า ไอโซโทปกัมมันตรังสีหรือ สารกัมมันตรังสีส่วนธาตุกัมมันตรังสีคือธาตุที่ทุกไอโซโทปสามารถแผ่รังสีได้โดยการสลาย ตัวสามารถทำ ให้เกิดอนุภาคหรือรังสี เช่น แอลฟา บีตา แกมมา ระยะเวลาที่นิวเคลียส ของไอโซโทปกัมมันตรังสีสลายตัวจนเหลือครึ่งหนึ่งของปริมาณเดิม เรียกว่า ครึ่งชีวิต ซึ่ง เป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปกัมมันตรังสีที่ไม่ขึ้นกับปริมาณตั้งต้นของไอโซโทป กัมมันตรังสีไอโซโทปกัมมันตรังสีสามารถนำ มาใช้ประโยชน์ได้หลายประการ เช่น หาอายุ ของวัตถุโบราณ ใช้ในทางการแพทย์การเกษตร
ธาตุในธรรมชาติสามารถนำ ไปใช้ประโยชน์ได้การใช้ประโยชน์จากธาตุควรคำ นึงถึง ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม ซึ่งการทราบแนวโน้มสมบัติของธาตุเป็นพื้นฐาน สำ คัญที่นำ ไปสู่การเลือกธาตุไปใช้ประโยชน์ได้อย่างเหมาะสม


































































ไม่มีความคิดเห็น:
แสดงความคิดเห็น